
 Información general: Las náuseas y los vómitos durante el embarazo ocurren con mayor frecuencia durante el primer trimestre. Si no se trata, el desarrollo de hiperemesis gravídica puede provocar más complicaciones caracterizadas por deshidratación y anomalías electrolíticas. 1 Ondansetrón, un antagonista del receptor 5-HT3, se ha convertido rápidamente en el fármaco recetado con más frecuencia en los Estados Unidos para las náuseas y los vómitos durante el embarazo. 2 Con la creación de una tableta de disolución oral en 2006, la popularidad del ondansetrón como antiemético continúa aumentando. De hecho, un estudio de 2014 muestra que casi una cuarta parte de todas las mujeres embarazadas en los Estados Unidos lo utilizan. 3 Existe incertidumbre en la literatura sobre la asociación entre ondansetrón y defectos de nacimiento. Si bien algunos estudios informan que no existe un mayor riesgo de anomalías congénitas entre las mujeres que tomaron este antiemético al comienzo del embarazo, otra evidencia sugiere que puede estar asociado con paladar hendido y malformaciones cardíacas. 2 Los autores de este estudio intentaron investigar la asociación entre la exposición a Ondansetrón durante el primer trimestre del embarazo y el riesgo de malformaciones congénitas en los recién nacidos utilizando una cohorte nacional de mujeres embarazadas con seguro público.
Información general: Las náuseas y los vómitos durante el embarazo ocurren con mayor frecuencia durante el primer trimestre. Si no se trata, el desarrollo de hiperemesis gravídica puede provocar más complicaciones caracterizadas por deshidratación y anomalías electrolíticas. 1 Ondansetrón, un antagonista del receptor 5-HT3, se ha convertido rápidamente en el fármaco recetado con más frecuencia en los Estados Unidos para las náuseas y los vómitos durante el embarazo. 2 Con la creación de una tableta de disolución oral en 2006, la popularidad del ondansetrón como antiemético continúa aumentando. De hecho, un estudio de 2014 muestra que casi una cuarta parte de todas las mujeres embarazadas en los Estados Unidos lo utilizan. 3 Existe incertidumbre en la literatura sobre la asociación entre ondansetrón y defectos de nacimiento. Si bien algunos estudios informan que no existe un mayor riesgo de anomalías congénitas entre las mujeres que tomaron este antiemético al comienzo del embarazo, otra evidencia sugiere que puede estar asociado con paladar hendido y malformaciones cardíacas. 2 Los autores de este estudio intentaron investigar la asociación entre la exposición a Ondansetrón durante el primer trimestre del embarazo y el riesgo de malformaciones congénitas en los recién nacidos utilizando una cohorte nacional de mujeres embarazadas con seguro público.
Artículo: Huybrechts KF, et al. Asociación del uso materno de ondansetrón durante el primer trimestre con malformaciones cardíacas y fisuras bucales en la descendencia. JAMA . 2018. PMID: 30561479
Pregunta clínica: ¿La exposición al ondansetrón durante el primer trimestre del embarazo está asociada con un mayor riesgo de malformaciones congénitas en los recién nacidos (centrándose en malformaciones cardíacas y fisuras orales)?
Que hicieron:
- Un estudio de cohorte retrospectivo que analiza ≈1,8 millones de embarazos del Medicaid Analytic eXtract (MAX) a nivel nacional que se ha utilizado anteriormente para estudiar la seguridad de los medicamentos durante el embarazo. 4
- Se consideró que las mujeres estaban “expuestas” si surtían al menos una receta de Ondansetrón durante los primeros 3 meses de embarazo (período de organogénesis).
- Las mujeres se consideraron “no expuestas” si no surtieron al menos una receta de Ondansetrón durante los primeros 3 meses de embarazo.
- Se utilizaron como grupo de referencia alternativo las mujeres que obtuvieron una receta durante los primeros 90 días del embarazo para piridoxina (con o sin doxilamina), prometazina, metoclopramida o cualquiera de estos tratamientos alternativos.
- La presencia de malformaciones congénitas se definió mediante un algoritmo basado en diagnósticos hospitalarios o ambulatorios y códigos de procedimiento en el registro materno o fetal.
- Los autores también analizaron posibles factores de confusión y/o sustitutos de los factores de confusión.
- Los autores utilizaron puntuaciones de propensión para ajustar un gran número de covariables y se realizaron los siguientes análisis:
- Análisis primario ajustado = Para tener en cuenta el posible efecto de confusión de la indicación de tratamiento y sus factores asociados
- Análisis secundario ajustado = Para tener en cuenta todas las posibles variables de confusión. Estos resultados fueron interpretados como exploratorios.
- Análisis confirmatorio = El análisis de puntuación de propensión de alta dimensión incluyó 200 covariables definidas empíricamente además de las covariables preespecificadas.
- Análisis de sensibilidad = Realizados para probar la solidez de los resultados primarios.
- Los dos grupos (expuestos y no expuestos) se evaluaron mediante diferencias estandarizadas. Una diferencia estandarizada absoluta superior a 0,1 se consideró un indicador de desequilibrios sustanciales entre los dos grupos de exposición.
- Para cada uno de los resultados se calcularon los riesgos relativos absolutos y no ajustados y las diferencias de riesgo con sus intervalos de confianza del 95%.
Criterios de inclusión:
- Mujeres de 12 a 55 años
- Cobertura de Medicaid desde 3 meses antes de la fecha de su último período menstrual hasta 1 mes después del parto.
- Obtuvo al menos una receta de Ondansetrón durante los primeros tres meses de embarazo.
- Bebés con cobertura de Medicaid durante los primeros tres meses de vida, a menos que hayan muerto antes
Criterio de exclusión:
- Embarazos con exposición a otros teratógenos conocidos (es decir, warfarina, agentes antineoplásicos, litio, isotretinoína, misoprostol, talidomida, etc.)
- Embarazos con una anomalía cromosómica
- Mujeres que obtuvieron una receta de Ondansetrón en los 3 meses previos al embarazo.
Resultados:
- Primario
-
- Malformaciones cardíacas diagnosticadas durante los primeros 90 días después del parto.
- Malformaciones de la fisura bucal diagnosticadas durante los primeros 90 días después del parto
- Secundario
-
- Malformaciones congénitas en general
- Subgrupos específicos de malformaciones cardíacas (es decir, defectos conotruncales, defectos de ventrículo único, defectos del tabique interventricular, etc.)
- Subgrupos específicos de malformaciones orales leporinas (es decir, paladar hendido, labio hendido, labio y paladar hendido)
- Se evaluaron riesgos de otras malformaciones específicas (Oculares, de oído, del SNC, respiratorias, gastrointestinales, urinarias, genitales, etc.)
Lo que cambiaron:
- Durante su análisis, los autores cambiaron el grupo de referencia a mujeres que obtuvieron una receta para un antiemético diferente durante el primer trimestre para que fuera más comparable con las mujeres expuestas a Ondansetrón que con las mujeres que nunca fueron tratadas con antieméticos durante el embarazo.
- La exposición se redefinió como haber surtido 2 o más recetas de Ondansetrón durante el primer trimestre y la ventana de exposición se definió como de 6 a 12 semanas después de la fecha del último período menstrual.
Resultados:
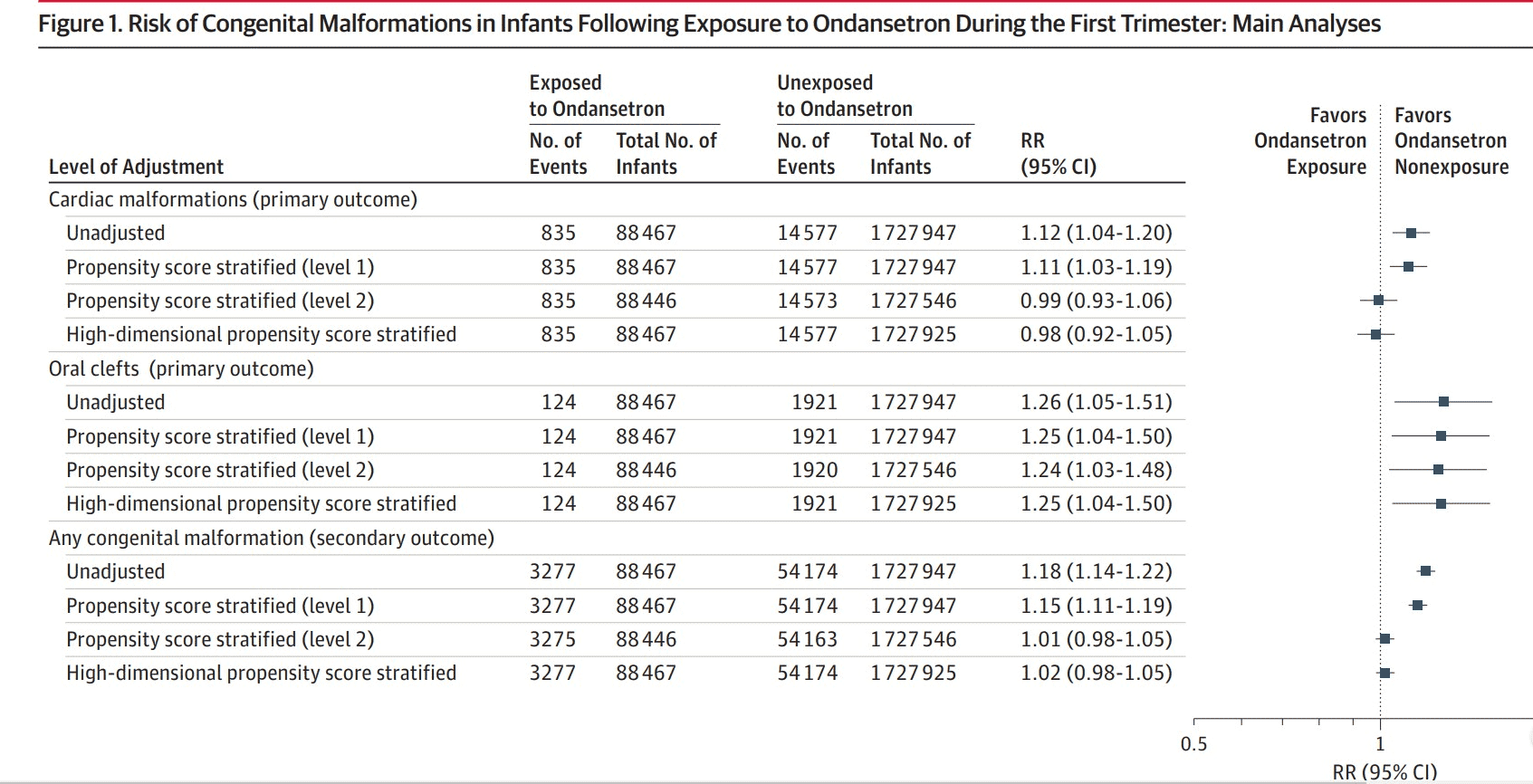
- Del total de 1.816.144 embarazos, 88.467 (4,9%) estuvieron expuestos a ondansetrón mientras que 1.727.947 no estuvieron expuestos.
- Hubo un total de 1.502.895 mujeres que aportaron lo siguiente a la cohorte:
- 1 embarazo: 1.251.216 (83,3%)
- 2 embarazos: 203.037 (13,5%)
- 3 o más embarazos: 48.642 (3,2%)
Resultados críticos:
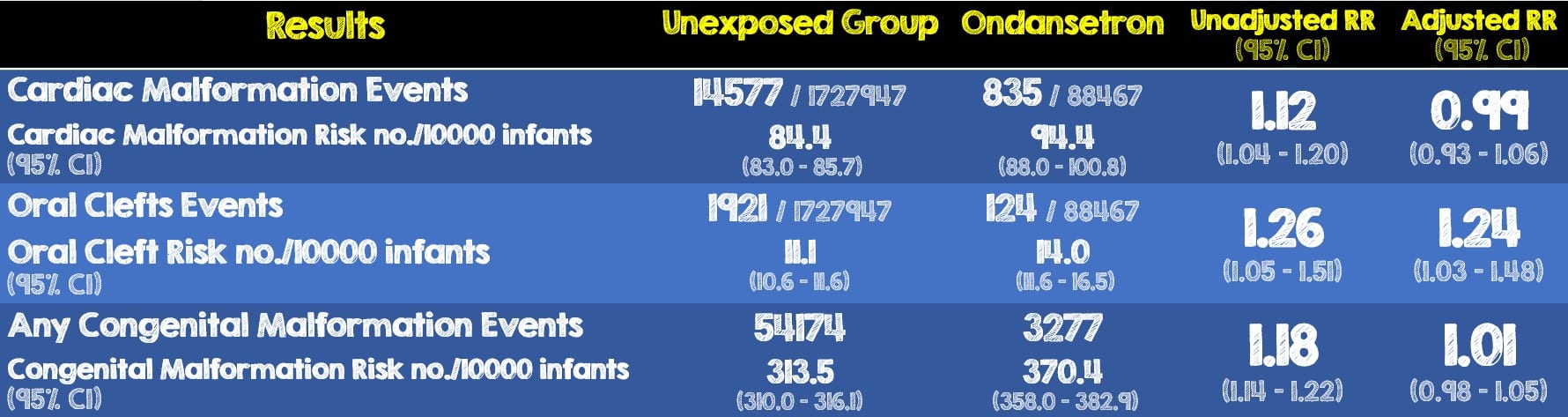
- Hubo un pequeño aumento en el riesgo de fisuras orales asociadas con la exposición a ondansetrón. El límite superior del riesgo relativo ajustado del IC del 95% fue 1,48, lo que corresponde a 5 casos adicionales por cada 10.000 nacimientos expuestos prenatalmente.
- Los resultados cuando se utilizaron mujeres expuestas a otros antieméticos como grupo de referencia fueron consistentes con los análisis principales (RR ajustado para malformaciones cardíacas, 1,01; IC del 95 %, 0,92-1,12; para fisuras orales, RR ajustado, 1,32; IC del 95 %, 1,03- 1,70 y para cualquier malformación congénita RR, 1,00; IC 95%, 0,95-1,05
- Los hallazgos generalmente no fueron sensibles a los cambios en la definición de exposición (≥2 prescripciones, 6-12 semanas)
Fortalezas:
- A diferencia de estudios anteriores en los que la evaluación de la exposición se basó en los informes de las propias mujeres, el uso de registros médicos de una base de datos grande y conocida elimina el sesgo de informes de las propias mujeres que puede ocurrir cuando las mujeres dan a luz a un bebé con una malformación congénita.
- El uso de la base de datos MAX y, más específicamente, la recopilación prospectiva de información sobre los medicamentos surtidos elimina el posible sesgo de recuperación.
- Se utilizaron análisis de sensibilidad para probar la solidez de los resultados primarios.
- Los autores cuantificaron el potencial de sesgo de selección debido a la restricción de la cohorte a los nacidos vivos utilizando un escenario más extremo.
- Para reducir aún más la probabilidad de variables de confusión, los pacientes que tomaban otros antieméticos se utilizaron como grupos de referencia alternativos en análisis adicionales y, por lo tanto, se compararon tres grupos en total.
- mujeres no expuestas
- Mujeres expuestas a ondansetrón
- Mujeres expuestas a otros antieméticos.
- Se evitó contaminar el grupo de referencia al excluir a las mujeres que surtieron la receta 3 meses antes del inicio del embarazo, ya que aún podrían tener el medicamento disponible para ingerir después del inicio del embarazo.
- Se examinó el registro materno para detectar anomalías congénitas porque las reclamaciones de Medicaid a veces se registran bajo la madre antes de que se haya procesado la elegibilidad del bebé.
- Se consideró una gama muy amplia de posibles factores de confusión y sustitutos de los mismos (como indicaciones de tratamiento, datos demográficos, condiciones maternas, uso concomitante de medicamentos, etc.)
- Se implementó un análisis confirmatorio de 200 covariables definidas empíricamente además de las covariables preespecificadas para tener en cuenta posibles factores de confusión residuales.
Limitaciones:
- Las covariables no medidas pueden servir como variables de confusión desconocidas que sesgan los datos. Ésta es una limitación común y bien conocida del uso de una puntuación de propensión.
- La prevalencia al nacer se utilizó como indicador del riesgo absoluto bajo el supuesto de que sólo una pequeña proporción de fetos con defectos no sindrómicos morirían o terminarían en el útero. Por lo tanto, el riesgo real puede ser ligeramente mayor.
- Los grupos no estaban bien equilibrados ya que las mujeres del grupo expuesto a ondansetrón tenían más marcadores de enfermedades comórbidas y gravedad de la enfermedad en el análisis no ajustado.
- Surtir una receta no significa necesariamente que el paciente realmente tomó el medicamento, especialmente si solo se surtió una vez.
- Esta cohorte de embarazos se limitó a los nacidos vivos y, por lo tanto, se pasaron por alto las malformaciones congénitas graves que provocaron la pérdida o la interrupción del embarazo.
- Además, el uso de una base de datos de Medicaid compuesta principalmente por mujeres desfavorecidas limita la validez externa de este estudio, ya que muchos países, además de Estados Unidos, tienen una forma de atención médica universal.
- Los autores no tuvieron en cuenta las experiencias previas de los pacientes con Ondansetrón y cómo eso puede sesgar los datos, especialmente si Ondansetrón se tomó antes del embarazo.
- El período de tiempo de este estudio, de 2000 a 2013, también puede contribuir al sesgo de selección.
- Puede haber algún sesgo importante a favor del uso de Ondansetron, ya que varios de los autores han recibido subvenciones de GlaxoSmithKline, el único creador de Ondansetron desde mediados de los años 1980 hasta 2006.
Discusión:
- Este estudio amplía en gran medida la evidencia disponible actualmente, que se limitó a una cohorte de 1349 mujeres expuestas y un estudio de casos y controles anterior que no mostró ningún riesgo basado en 11 casos expuestos. 5-7
- Es importante recordar que este estudio investiga los posibles efectos a largo plazo de un ondansetrón completo recetado durante varios días durante el primer trimestre. Es posible que estos efectos no sean aplicables a una sola dosis (o dos) administrada en el departamento de emergencias.
- Cuando los autores utilizaron mujeres expuestas a otros antieméticos como grupo de referencia y las compararon con el análisis principal de Ondansetrón, no hubo diferencias significativas. Además, los resultados fueron similares entre los agentes antieméticos individuales.
- Los autores redefinieron la exposición por haber surtido 2 o más recetas de ondansetrón para evaluar el efecto potencial de la exposición a una discrepancia y capturar a los pacientes que surtieron Y completaron su primera receta.
- Su redefinición de la ventana de exposición a 6-12 semanas se justificó por ser este el período de mayor sensibilidad a los teratógenos para las fisuras orales. Los hallazgos no fueron sensibles a los cambios ni en la exposición ni en la redefinición de la ventana de exposición.
- La puntuación de propensión ayuda a limitar las variables de confusión; sin embargo, se realizó una cantidad significativa de manipulación estadística, como lo demuestran los múltiples análisis y varios niveles de puntuación, para que los autores llegaran a su conclusión.
- Hay un componente de sesgo experiencial personal que los autores han omitido. Una paciente que tomó ondansetrón antes durante el embarazo con un alivio exitoso de sus síntomas y sin causar daño a su recién nacido, puede estar más inclinada a tomarlo nuevamente sin tener en cuenta los presuntos riesgos de malformación congénita. Los autores no hicieron mención alguna sobre la exclusión de estos pacientes o incluso si la base de datos contaba con este tipo de información.
- Los autores justifican su uso del período de 2000 a 2013 como los datos más recientes disponibles en el momento de realizar el estudio; sin embargo, no está claro por qué solo se remontan al año 2000, cuando Ondansetron existe desde mediados de la década de 1980.
- No se puede pasar por alto el uso de una cohorte principalmente desfavorecida (es decir, la base de datos de Medicaid). Si esta base de datos hubiera venido de otro país, distinto de Estados Unidos, donde existe un sistema de salud más unificado con acceso más fácil a bases de datos y registros, los resultados probablemente podrían ser muy diferentes.
- Por último, un punto importante que los autores no parecen abordar es el cuadro clínico general de cada paciente. Aunque el riesgo de hendidura bucal es pequeño, es importante considerar siempre los beneficios y los daños potenciales a corto y largo plazo de todas y cada una de las intervenciones, así como cómo se aplican a cada paciente en particular.
Conclusiones del autor:
- "Entre los recién nacidos de madres inscritas en Medicaid, la exposición al ondansetrón en el primer trimestre no se asoció con malformaciones cardíacas o malformaciones congénitas en general después de tener en cuenta los factores de confusión medidos, pero se asoció con un pequeño aumento del riesgo de fisuras orales".
Nuestra conclusión:
- Dado que no ha sido éticamente posible realizar un ECA sobre el efecto de Ondansetrón en malformaciones congénitas, este estudio nos proporciona información útil adicional sobre los riesgos potenciales de malformaciones congénitas cuando Ondansetrón se usa durante el embarazo. Hay muchos sesgos y limitaciones en este estudio que pueden limitar sus hallazgos; sin embargo, al ser una de las bases de datos más grandes disponibles actualmente, respalda la seguridad y el uso de Ondansetrón para el cese de las náuseas y los vómitos en el primer trimestre del embarazo.
Conclusión clínica:
- En este estudio no se demostró que el uso de ondansetrón al principio del embarazo esté asociado con un aumento de malformaciones cardíacas o malformaciones congénitas en general; sin embargo, puede haber un pequeño aumento de la asociación con hendiduras orales. Por lo tanto, el ondansetrón intravenoso es una opción segura, cuando sea necesario, y este estudio debería brindar tranquilidad sobre la seguridad del ondansetrón en el primer trimestre del embarazo.
Referencias:
- Comité de Boletines de Práctica-Obstetricia. Boletín de práctica ACOG No. 189: Náuseas y vómitos del embarazo. Obstet Ginecol . 2018 PMID: 29266076
- Huybrechts KF, et al. Asociación del uso materno de ondansetrón durante el primer trimestre con malformaciones cardíacas y hendiduras bucales en la descendencia. JAMA . 2018. PMID: 30561479
- Taylor LG, et al. Uso de antieméticos entre mujeres embarazadas en los Estados Unidos: el uso creciente de ondansetrón. Farmacoepidemiol Medicamento Saf. 2017. PMID: 28220993
- Palmsten K, Huybrechts KF, Mogun H, et al. Aprovechamiento del extracto analítico de Medicaid (MAX) para evaluar medicamentos durante el embarazo: consideraciones de diseño. Más uno. 2013; PMID: 23840692
- Anderka M, et al. Medicamentos utilizados para tratar las náuseas y los vómitos del embarazo y el riesgo de defectos congénitos seleccionados. Defectos de nacimiento Res A Clin Mol Teratol. 2012. PMID: 22102545
- Parker SE y otros; Estudio nacional de prevención de defectos de nacimiento. Ondansetrón para el tratamiento de las náuseas y los vómitos durante el embarazo y el riesgo de defectos congénitos específicos. Obstet Ginecol. 2018. PMID: 29995744
- Danielsson B, et al. Uso de ondansetrón durante el embarazo y malformaciones congénitas en el lactante. Reproducción Toxicol. 2017. PMID: 25450422
Para obtener más información sobre este tema, consulte:
- PharmERToxGuy: Ondansetrón intravenoso en el primer trimestre del embarazo
Publicación revisada por pares por: Salim R. Rezaie, MD (Twitter: @srrezaie )
La publicación Asociación del uso materno de ondansetrón durante el primer trimestre con malformaciones cardíacas y fisuras bucales en recién nacidos apareció por primera vez en REBEL EM - Blog de medicina de emergencia .
