
 Antecedentes: El 24 de octubre de 2018, Roche, el fabricante de oseltamivir, anunció que la Administración de Medicamentos y Alimentos de EE. UU. (FDA) aprobó Xofluza (baloxavir marboxil) para el tratamiento de la influenza aguda no complicada en personas de 12 años de edad o más. Históricamente, ha habido dos clases de tratamiento contra la influenza, los inhibidores del canal iónico M2 y los inhibidores de la neuraminidasa; sin embargo, los virus de la influenza circulantes se han vuelto en gran medida resistentes a los inhibidores del canal iónico M2 y la aparición de nuevas cepas de influenza (H1N1) podría amenazar la utilidad de los inhibidores de la neuraminidasa también. He escrito anteriormente sobre la debacle del Tamiflu y por qué este es un medicamento que no debemos recetar a pacientes inmunocompetentes. En esta publicación, intentamos responder una pregunta diferente: ¿Es la aprobación de baloxavir otra debacle o realmente mejora los resultados orientados al paciente?
Antecedentes: El 24 de octubre de 2018, Roche, el fabricante de oseltamivir, anunció que la Administración de Medicamentos y Alimentos de EE. UU. (FDA) aprobó Xofluza (baloxavir marboxil) para el tratamiento de la influenza aguda no complicada en personas de 12 años de edad o más. Históricamente, ha habido dos clases de tratamiento contra la influenza, los inhibidores del canal iónico M2 y los inhibidores de la neuraminidasa; sin embargo, los virus de la influenza circulantes se han vuelto en gran medida resistentes a los inhibidores del canal iónico M2 y la aparición de nuevas cepas de influenza (H1N1) podría amenazar la utilidad de los inhibidores de la neuraminidasa también. He escrito anteriormente sobre la debacle del Tamiflu y por qué este es un medicamento que no debemos recetar a pacientes inmunocompetentes. En esta publicación, intentamos responder una pregunta diferente: ¿Es la aprobación de baloxavir otra debacle o realmente mejora los resultados orientados al paciente?
¿Cómo funciona el baloxavir (advertencia: esto es algo súper nerd de replicación viral)?
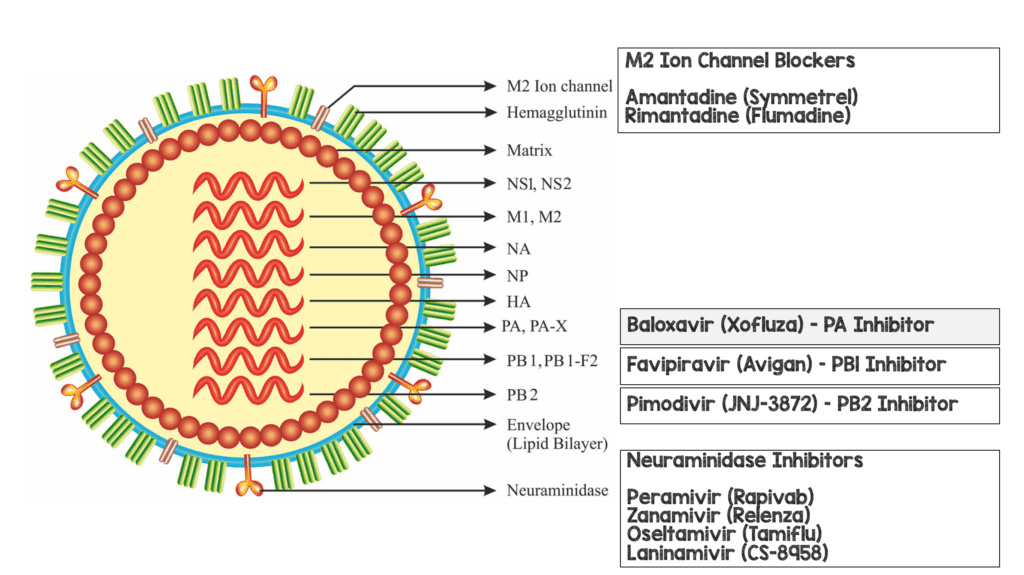
La influenza tiene un complejo de polimerasa compuesto por tres subunidades proteicas: proteína polimerasa básica 1 (PB1), proteína polimerasa básica 2 (PB2) y proteína polimerasa ácida (PA). Los tres componentes son esenciales para la replicación viral. La forma en que se replica la influenza es que la subunidad PB2 se une al ARN premensajero celular del huésped y es escindida por la endonucleasa en la subunidad PA. Este proceso permite la transcripción del ARN mensajero viral mediante la función de la ARN polimerasa de PB1. Baloxivir es un profármaco del componente selectivo de PA e inhibe la actividad de la endonucleasa.
Que hicieron:
- Esta publicación consistía en realidad en dos ensayos aleatorios, doble ciego, controlados con placebo, en los que participaron pacientes ambulatorios sanos con gripe aguda no complicada.
- El primer ensayo fue un estudio de fase 2 de rango de dosis de 10, 20 y 40 mg de baloxavir versus placebo en adultos japoneses, de 20 a 64 años, con influenza aguda desde diciembre de 2015 hasta marzo de 2016. La aleatorización de este ensayo fue hecho en una proporción de 1:1:1:1.
- El segundo ensayo fue un ensayo de fase 3 llamado CAPSTONE-1. Este fue un ensayo aleatorio, controlado con placebo de pacientes con enfermedades similares a la influenza, en los Estados Unidos y Japón, durante la temporada de influenza de diciembre de 2016 a marzo de 2017. Los pacientes de 20 a 64 años fueron aleatorizados en una proporción 2:2:1 para recibir una dosis oral única de baloxavir (40 mg para pacientes que pesaban <80 kg u 80 mg para pacientes ≥80 kg), oseltamivir en una dosis de 75 mg dos veces al día durante 5 días, o placebos equivalentes.
- Los pacientes adultos en los tres grupos del ensayo CAPSTONE-1 recibieron un régimen de 5 días de baloxavir y un placebo equivalente a oseltamivir, oseltamivir y un placebo equivalente a baloxavir, o solo placebo
- Se aleatorizó a pacientes adolescentes de entre 12 y 19 años de edad en una proporción de 2:1 para recibir baloxavir o placebo solo el día 1 (sin oseltamivir).
Resultados:
- Primario: Tiempo hasta el alivio de los síntomas de la influenza en la población infectada por intención de tratar (definido como: tiempo desde el inicio del régimen de prueba hasta el momento en que los pacientes calificaron los siete síntomas relacionados con la influenza como ausentes o leves durante al menos menos 21,5 horas)
-
Secundario:
- Tiempo hasta la resolución de la fiebre.
- Es hora de volver a la salud habitual.
- Complicaciones recientes que conducen al uso de antibióticos
-
Virológico:
- Cambios desde el inicio en los títulos de virus infecciosos y ARN viral
- Duración de la detección del virus
- Frecuencia de aparición de cambios de aminoácidos asociados con una susceptibilidad reducida al baloxavir
-
Seguridad:
- Frecuencia y gravedad de los eventos adversos.
Inclusión:
- Pacientes capaces de dar su consentimiento informado por escrito y cumplir con todos los procedimientos del estudio.
- En el estudio de fase 2, los pacientes debían tener una confirmación virológica de influenza para recibir tratamiento; En el estudio de fase 3, los pacientes no tenían que tener confirmación virológica de influenza (es decir, enfermedad similar a la gripe)
- 1.044 pacientes con gripe confirmada (≈75%)
- 356 pacientes negativos para gripe (≈25%)
- Edad ≥12 años a ≤64 años
- Pacientes con diagnóstico de influenza confirmado por todo lo siguiente:
- Fiebre ≥38 grados Celsius (axilar)
- Al menos uno de los siguientes síntomas sistémicos generales.
- Dolor de cabeza
- Fiebre o escalofríos
- Dolor muscular o articular
- Fatiga
- Al menos uno de los siguientes síntomas respiratorios.
- Tos
- Dolor de garganta
- Congestión nasal
- Intervalo de tiempo entre la aparición de los síntomas y el examen previo a la dosis ≤48 horas. Inicio de los síntomas definidos como:
- Hora del primer aumento de la temperatura corporal (un aumento de al menos 1 grado Celsius con respecto a la temperatura corporal normal)
- Momento en el que el paciente experimenta al menos un síntoma general o respiratorio
- Mujeres en edad fértil que aceptaron utilizar un método anticonceptivo altamente eficaz durante 3 meses después de la primera dosis del fármaco del estudio.
Exclusión (Y no, no bromeamos… esta lista es extensa):
- Infección por influenza grave que requiere tratamiento hospitalario
- Pacientes ≥20 años con alergia conocida al oseltamivir
- Pacientes con cualquiera de los siguientes factores de riesgo:
- Mujeres que están embarazadas o dentro de las 2 semanas posteriores al parto.
- Residentes de centros de atención a largo plazo
- Enfermedades respiratorias crónicas, incluido el asma bronquial.
- Trastornos neurológicos y del desarrollo neurológico, incluidos trastornos del cerebro, la médula espinal, los nervios periféricos y los músculos.
- Enfermedad cardíaca como cardiopatía congénita, insuficiencia cardíaca congestiva o enfermedad de las arterias coronarias, excluida la hipertensión.
- Indios americanos y nativos de Alaska
- Trastornos de la sangre como la anemia de células falciformes.
- Trastornos endocrinos, incluida la diabetes mellitus.
- Trastornos renales
- Trastornos hepáticos
- Desordenes metabólicos
- Sistema inmunológico comprometido (es decir, terapia inmunosupresora, cáncer en quimioterapia, virus de inmunodeficiencia humana)
- Obesidad mórbida (IMC ≥40)
- Pacientes que no pueden tragar tabletas o cápsulas.
- Recibió previamente baloxavir
- <40 kg de peso
- Pacientes expuestos a un fármaco en investigación dentro de los 30 días anteriores a los exámenes previos a la dosis.
- Lactancia materna o prueba de embarazo positiva.
- Infecciones concurrentes que requieren terapia antimicrobiana sistémica y/o antiviral.
- Recibió peramivir, laninamivir, oseltamivir, zanamivir, rimantadina, umifenovir o amantadina dentro de los 30 días anteriores
- Recibió un anticuerpo monoclonal en investigación para una enfermedad viral en el último año.
- Enfermedades subyacentes crónicas graves.
- Aclaramiento de creatinina conocido ≤60 ml/min
- Es poco probable que los pacientes cumplan con las visitas e intervenciones del estudio requeridas.
Resultados (estos son 2 ensayos en 1):
Ensayo de fase 2 (estudio de búsqueda de dosis)
- 400 pacientes fueron aleatorizados, pero sólo 389 completaron el ensayo.
- Sólo entre el 61 y el 71% de los pacientes estaban infectados con el virus de la influenza confirmado.

- Los 3 grupos de Baloxavir tuvieron títulos virales más bajos en los días 2 y 3 en comparación con el grupo de placebo.
- 4/182 (2,2%) de los pacientes con baloxavir desarrollaron después del tratamiento sustituciones de aminoácidos PA que confieren una mayor resistencia al baloxavir.
Ensayo de fase 3 (CAPSTONE-1)
- 1.436 pacientes fueron aleatorizados, pero sólo 1.366 pacientes completaron el ensayo y 1.064 fueron incluidos en la población infectada por intención de tratar.
- Sólo el 52,9% de los pacientes iniciaron el régimen de prueba dentro de las 24 horas posteriores al inicio de los síntomas.
- La influenza A (H3N2) representó entre el 84,8 y el 88,1 % de las infecciones en los tres grupos del ensayo.
- El 77,2% de los pacientes se inscribieron en Japón.
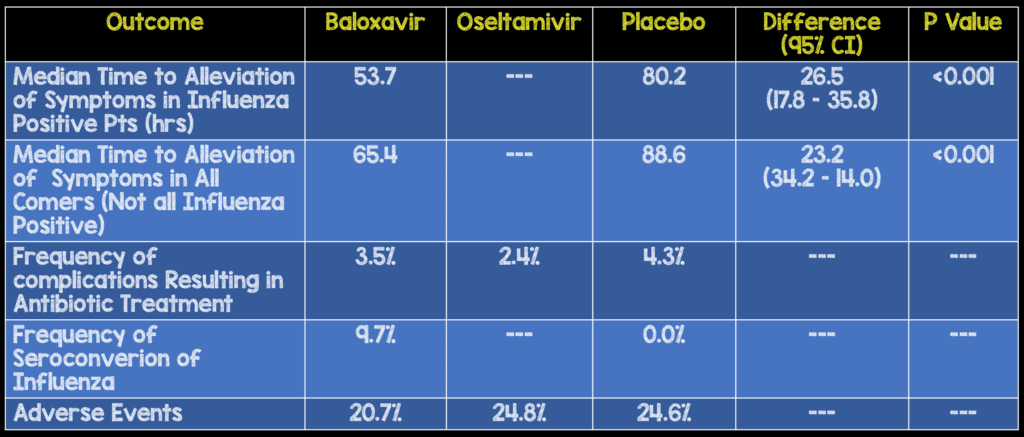
- El tiempo medio hasta el alivio de los síntomas en adolescentes también se redujo en 38,6 horas (p = 0,006)
- El alivio de los síntomas fue mayor en los pacientes que iniciaron el régimen de prueba dentro de las 24 horas posteriores al inicio de los síntomas en comparación con aquellos que lo iniciaron más tarde:
- Tratamiento ≤24 h diferencia de mediana, 32,8 h; p<0,001
- Tratamiento >24 h diferencia de mediana, 13,2 h; p = 0,008
- No hubo diferencias en el tiempo transcurrido hasta el alivio de los síntomas entre los grupos de baloxavir y oseltamivir.
- También hubo un tiempo medio más corto hasta la resolución de la fiebre con baloxavir frente a placebo (24,5 horas frente a 42,0 horas)
- Baloxavir se asoció con disminuciones significativamente más rápidas en la carga viral infecciosa que el placebo versus oseltamivir el día 1 después del inicio de los medicamentos y una duración media más corta de la detección del virus.
Fortalezas:
- Cuestión importante a investigar ya que la gripe pandémica sigue siendo un tema importante
- Los pacientes de todas las edades recibieron su primera dosis del medicamento del ensayo bajo observación directa para garantizar que se tomara el medicamento.
- Pacientes igualados al inicio del estudio entre grupos en términos de características demográficas y clínicas.
- Los investigadores desconocen las asignaciones del grupo de prueba.
Limitaciones:
- El acceso de los autores a los datos no estuvo restringido por acuerdos de confidencialidad.
- Diseño del estudio realizado por el patrocinador del estudio.
- Los datos fueron compilados por el patrocinador y analizados por un estadístico empleado por el patrocinador.
- Una prueba rápida de antígeno positiva para la influenza fue un criterio de ingreso para el ensayo de fase 2, pero no para el ensayo de fase 3.
- Una lista de exclusión extensa limita la generalización del uso de este medicamento en la mayoría de las poblaciones de pacientes (es decir, eran pacientes jóvenes sanos, esencialmente sin problemas médicos).
- En la lista de ClinicalTrials.gov [2] hay 1 resultado primario y 19 resultados secundarios, con varios puntos de tiempo para cada uno evaluado; sin embargo, en el manuscrito principal obtenemos puntos de tiempo cuidadosamente seleccionados que muestran beneficios sin información sobre todos los puntos finales secundarios enumerados o períodos de tiempo evaluados (es decir, no contamos con la publicación completa de los datos)
- El estudio necesitó 1494 pacientes para proporcionar al menos un 90 % de potencia para detectar una diferencia de 28 horas en el tiempo medio hasta el alivio de los síntomas y no alcanzó esta cifra. Además, de los 1.400 aleatorizados, 400 fueron excluidos, lo que generó un sesgo de selección.
- No está claro si el aumento de la seroconversión del virus asociado con baloxavir afectará la susceptibilidad, pero hubo una mediana de tiempo más larga hasta el alivio de los síntomas en pacientes con seroconversión.
- No está claro si una carga viral reducida se asocia con un riesgo reducido de transmisión del virus.
- El 88% de los pacientes tenían influenza H3N2. Esto significa que los resultados de este ensayo no tienen aplicabilidad a otras cepas según estos datos.
- El grupo placebo no recibió una terapia real guiada por síntomas (es decir, AINE, APAP, descongestionantes)
- No está claro cómo se realizó la aleatorización
Discusión:
- Costo del baloxavir = $150,00 USD por una dosis única (la compañía afirma que planea ofrecer un cupón que reducirá el precio a $30,00 USD para personas con seguro comercial)
- Costo de oseltamivir (Tamiflu) = $100,00 dólares estadounidenses por un curso de cinco días
- La aprobación del baloxavir se basa en un ensayo único, relativamente pequeño y con una población limitada, patrocinado por un fármaco, con ¾ de los pacientes, fuera de los EE. UU., es irresponsable en el mejor de los casos y criminal en el peor.
- Los autores afirman que no existe ningún problema de seguridad; sin embargo, un estudio de este tamaño no puede proporcionar datos reales de seguridad.
- Según el estudio de búsqueda de dosis de fase 2, ¿tendría más sentido optar por la dosis más baja posible que proporcione a las personas casi el mismo tiempo de alivio?
- La dosificación variable basada en el peso no se estudió antes del ensayo de fase 3
Conclusión del autor: “La dosis única de baloxavir no tuvo problemas de seguridad evidentes, fue superior al placebo para aliviar los síntomas de la influenza y fue superior tanto al oseltamivir como al placebo para reducir la carga viral 1 día después del inicio del régimen de prueba en pacientes con influenza no complicada. También se observaron pruebas del desarrollo de una menor susceptibilidad al baloxavir después del tratamiento”.
Punto clínico para recordar: De acuerdo con todos los demás estudios sobre medicamentos antivirales para la influenza, baloxavir parece disminuir la duración de los síntomas , especialmente en pacientes tratados dentro de las 24 horas posteriores a los síntomas, PERO una lista de exclusión masiva, el costo del medicamento, una mayor resistencia después inicio, los resultados solo son aplicables al H3N2 (88% de los pacientes con gripe), no hay comparación con la atención estándar (es decir, terapia basada en síntomas), estudio patrocinado por la industria farmacéutica y no hay resultados orientados al paciente, es difícil argumentar a favor del uso de baloxivir. en pacientes con influenza confirmada. Este ensayo debería ser un recordatorio de por qué un ensayo financiado por la industria, sin la publicación completa de los datos y criterios de valoración cuidadosamente seleccionados no debe utilizarse para cambiar la práctica.
Referencias:
- Hayden FG et al. Baloxavir Marboxil para la influenza no complicada en adultos y adolescentes. NEJM Septiembre de 2018. PMID: 30184455
- ClinicalTrials.gov [El enlace está AQUÍ ]
Publicación revisada por pares por: Anand Swaminathan, MD (Twitter: @EMSwami )
La publicación Baloxavir (Xofluza), un nuevo medicamento antiviral contra la influenza, está aprobado por la FDA, pero ¿funciona? apareció por primera vez en REBEL EM - Blog de Medicina de Emergencia .
