
 Antecedentes: Actualmente, no existen medicamentos aprobados para el tratamiento de COVID-19, pero existen muchos agentes en investigación que han demostrado actividad antiviral contra el SARS-CoV-2 in vitro. Lamentablemente, los estudios in vitro no siempre se extrapolan a la atención clínica. Los estudios in vitro de remdesivir demuestran la inhibición de los coronavirus humanos y animales probados, incluido el SARS-CoV-2. Sin embargo, aún no se ha establecido la eficacia clínica y antiviral del remdesivir en la COVID-19. El título de esta publicación es “se acaban de publicar dos ensayos más sobre Remdesivir”, pero en realidad son 1,5 ensayos ya que no tenemos el lanzamiento completo del segundo ensayo (ver discusión).
Antecedentes: Actualmente, no existen medicamentos aprobados para el tratamiento de COVID-19, pero existen muchos agentes en investigación que han demostrado actividad antiviral contra el SARS-CoV-2 in vitro. Lamentablemente, los estudios in vitro no siempre se extrapolan a la atención clínica. Los estudios in vitro de remdesivir demuestran la inhibición de los coronavirus humanos y animales probados, incluido el SARS-CoV-2. Sin embargo, aún no se ha establecido la eficacia clínica y antiviral del remdesivir en la COVID-19. El título de esta publicación es “se acaban de publicar dos ensayos más sobre Remdesivir”, pero en realidad son 1,5 ensayos ya que no tenemos el lanzamiento completo del segundo ensayo (ver discusión).
Artículo: Wang Y et al. Remdesivir en adultos con COVID-19 grave: un ensayo multicéntrico, aleatorizado, doble ciego y controlado con placebo. Lancet 2020. [ Publicación electrónica antes de la impresión ]
Pregunta clínica: ¿Remdesivir intravenoso administrado durante 10 días reduce el tiempo hasta la mejoría clínica en comparación con el placebo en pacientes ingresados en el hospital con neumonía por COVID-19?
Que hicieron:
- Ensayo multicéntrico aleatorizado, doble ciego y controlado con placebo en 10 hospitales de Hubei, China
- Paciente asignado al azar en proporción 2:1 a:
- Remdesivir intravenoso (200 mg el día 1, seguido de 100 mg una vez al día los días 2 a 10)
- Placebo x10d
- A los pacientes se les permitió el uso concomitante de lopinavir-ritonavir, interferones y corticosteroides.
Resultados:
-
Primario: Tiempo hasta la mejoría clínica hasta el día 28 (Tiempo en días desde la aleatorización hasta el punto de disminución de dos niveles en una escala ordinal de estado clínico de seis puntos o el alta viva del hospital, lo que ocurra primero )
- Escala ordinal de 6 puntos
- 6 = muerte
- 5 = Ingreso hospitalario para ECMO o ventilación mecánica
- 4 = Ingreso hospitalario por VNI o CNAF
- 3 = Ingreso hospitalario para terapia con O2 (pero que no requiere CNAF ni VNI)
- 2 = Ingreso hospitalario pero que no requiere terapia con O2
- 1 = dado de alta o haber alcanzado los criterios de alta (definido como recuperación clínica que incluye normalización de la pirexia, RR <24 BPM, saturación de O2 >94 % en AR, alivio de la tos, todo mantenido durante al menos 72 h)
-
Secundario:
- Proporción de pacientes en cada categoría de la escala de 6 puntos los días 7, 14 y 28 después de la aleatorización
- Mortalidad por todas las causas al día 28
- Frecuencia de ventilación mecánica invasiva
- Duración de la oxigenoterapia.
- Duración del ingreso hospitalario
- Proporción de pacientes con infección nosocomial
-
Medidas Virológicas:
- ARN viral detectado
- Carga de ARN viral
-
Resultados de seguridad:
- Eventos adversos surgidos del tratamiento
- Eventos adversos graves
- Interrupción prematura del fármaco del estudio.
- Escala ordinal de 6 puntos
Inclusión:
- ≥18 años de edad
- Ingresado en el hospital con SARS-CoV-2 (confirmado mediante prueba PCR)
- Intervalo desde el inicio de los síntomas hasta la inscripción de ≤12 días
- Saturación de O2 de ≤94 % en aire ambiente o relación P/F ≤300 mmHg
- Neumonía confirmada radiológicamente
Exclusión:
- El embarazo
- Lactancia materna
- Cirrosis hepática
- ALT o AST >5x límite superior de lo normal
- Insuficiencia renal grave conocida (TFGe <30 ml/min/1,73 m 2 )
- Recibir TRR continua, HD o diálisis peritoneal
- Posibilidad de traslado a un hospital fuera del estudio en un plazo de 72h
- Inscripción en un estudio de tratamiento en investigación para COVID-19 en los 30 días previos a la detección
Resultados:
- 237 pacientes inscritos
- Remdesivir: 158 pacientes
- Placebo: 79 pacientes (se eliminó el consentimiento de 1 pt)
- La mayoría de los pacientes estaban en la categoría 3 (ingreso hospitalario que requirió O2 suplementario) de la escala ordinal (≈82% de los pacientes inscritos)
- Tiempo medio desde la aparición de los síntomas hasta el inicio del tratamiento del estudio 10 días (rango de 9 a 12 días)
- El 66% de los pacientes recibieron corticosteroides durante la hospitalización con una mediana de tiempo desde el inicio de los síntomas hasta el tratamiento de 8 días.
- El 39% de los pacientes recibieron corticosteroides antes de la inscripción en el estudio.
-
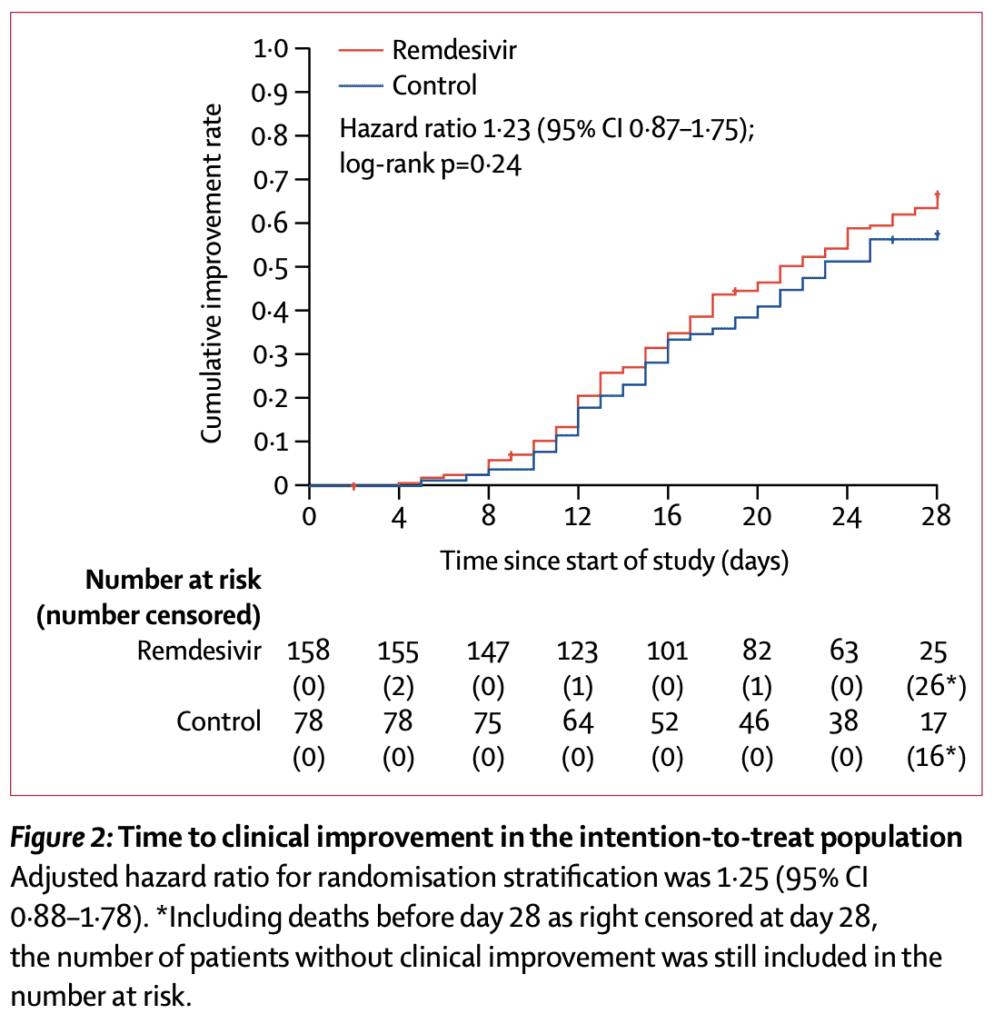
Tiempo medio hasta la mejora clínica (resultado primario):
- Remdesivir: 21d
- Placebo: 23d
- No estadísticamente significativo (HR 1,23; IC del 95%: 0,87 a 1,75)
- Mortalidad 28d:
- Remdesivir: 14%
- Placebo: 13%
- IC del 95%: -8,1 a 10,3
- No hubo diferencias en la mortalidad a los 28 días cuando remdesivir se usó dentro de los 10 días posteriores al inicio de los síntomas (remdisivir 11% versus placebo 15%), sin embargo, cuando se usó después de 10 días del inicio de los síntomas, la tasa de mortalidad a los 28 días fue numéricamente mayor (remdesivir 14% versus placebo 10%), pero tampoco el resultado fue estadísticamente significativo
- Duración de la ventilación mecánica:
- Remdesivir: 7,0 días
- Placebo: 15,5 días
- IC del 95%: -14,0 a 2,0 (no estadísticamente significativo)
- La duración de la ventilación mecánica invasiva en los supervivientes también fue numéricamente menor en el grupo de remdesivir (19 días frente a 42,0 días), pero nuevamente no fue estadísticamente significativa.
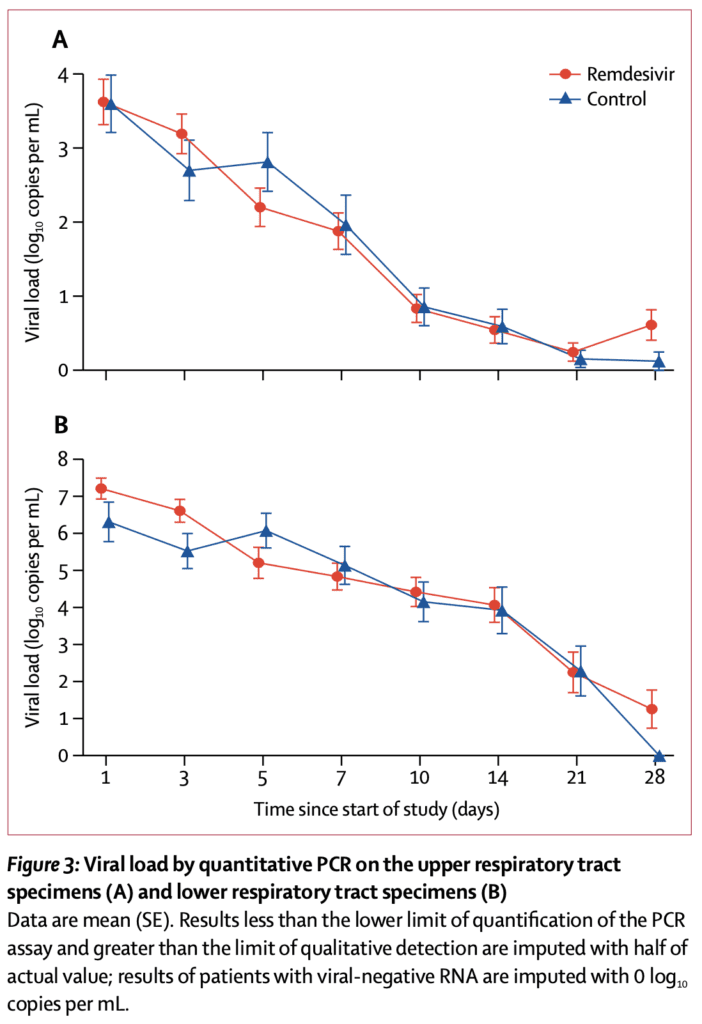
- Resultados virales:
- Remdesivir no eliminó el virus más rápido que el placebo
- Eventos adversos:
- Remdesivir: 66%
- Placebo: 64,0%
Fortalezas:
- Ensayo aleatorizado, doble ciego y controlado con placebo
- Aleatorización bien realizada
- Se utilizó un análisis por intención de tratar con todos los pacientes asignados al azar incluidos, lo que se extrapola mejor que un análisis por protocolo a la práctica general.
- A los pacientes se les permitió el uso concomitante de lopinavir-ritonavir, interferones y corticosteroides, sin embargo, estos estuvieron equilibrados entre los grupos.
- El número de eventos adversos fue demasiado pequeño para sacar conclusiones concretas sobre la seguridad.
Limitaciones:
- Los pacientes del grupo de remdesivir parecían tener ligeramente más comorbilidades (HTA, DM, CAD), una frecuencia respiratoria >24, y el grupo de placebo había sido sintomático durante ≤10 días con mayor frecuencia. Esto me hace preguntarme si este grupo estaba un poco más enfermo que el placebo y podría haber favorecido el placebo al inicio del estudio.
- El estudio finalizó anticipadamente, lo que redujo el poder estadístico del 80% al 58% (es decir, resultados frágiles). La razón de esto fue que las estrictas medidas de salud pública utilizadas en Wuhan provocaron marcadas reducciones en las presentaciones de nuevos pacientes y restricciones en la disponibilidad de camas de hospital.
- Los pacientes incluidos en este estudio no estaban muy enfermos (es decir, el 0,4 % recibían ventilación mecánica invasiva o ECMO)
- El uso frecuente de corticosteroides puede haber promovido la replicación viral del SARS-CoV-2, como se observó en el SARS y el MERS, pero estos estudios solo informaron una prolongación de la detección del ARN viral, no del virus infeccioso.
- No está claro si dosis más altas o ciclos de tratamiento más prolongados de remdesivir serían beneficiosos en pacientes con COVID-19 grave.
Discusión:
- La mayoría de los pacientes en este estudio tenían una enfermedad moderada, pero no una enfermedad grave. Además, muchos recibieron los medicamentos relativamente tarde, lo que probablemente ocurre fuera de la fase viral de la enfermedad. Esta podría ser una de las razones por las que no vemos una disminución en las cargas virales.
- El Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID) publicó datos preliminares de un ECA que involucró a 1063 pacientes con COVID-19 el 29 de abril de 2020 [2]
-
Ensayo: El ensayo de tratamiento adaptativo COVID-19 (ACTT) fue patrocinado por el NIAID
- 68 sitios (47 en EE. UU. y 21 en Europa/Asia)
- Pacientes asignados al azar a remdesivir versus placebo
- Criterio de valoración principal : tiempo hasta la recuperación (es decir, estar lo suficientemente bien para el alta hospitalaria o volver a la actividad normal)
-
Resultados:
- Tiempo de recuperación: los pacientes que recibieron remdesivir tuvieron un tiempo de recuperación un 31% más rápido que el placebo (P<0,001)
- Tiempo medio de recuperación: 11 días para remdesivir frente a 15 días para placebo
- Tasa de mortalidad: 8,0% para remdesivir frente a 11,6% para placebo (p = 0,059)
- Tendremos que esperar por el informe completo, pero este es el primer informe de un ensayo positivo hasta el momento (si miramos el sitio web Clinicaltrials.gov, parece que ya se han realizado cambios en su estudio en medio de la inscripción, lo que siempre me hace escéptico)
-
Ensayo: El ensayo de tratamiento adaptativo COVID-19 (ACTT) fue patrocinado por el NIAID
Cambios realizados en la presentación principal del ensayo ACTT [ el enlace está AQUÍ ]
- Se desconoce la farmacocinética de remdesivir en pacientes gravemente enfermos. Los estudios de regímenes de dosis más altas para los cuales existen datos de seguridad (es decir, 150 – 200 mg/día) justifican su consideración en ensayos futuros.
- Aunque la proporción general de pacientes con eventos adversos graves fue menor en el grupo de remdesivir en comparación con el placebo, es importante recordar que los investigadores suspendieron prematuramente la dosis de más pacientes en el grupo de remdesivir debido a eventos adversos que incluyen síntomas gastrointestinales, aumentos de aminotransferasa/bilirrubina, y empeoramiento del estado cardiopulmonar
- Aunque no fue estadísticamente significativo, remdesivir tuvo un tiempo numéricamente más rápido hasta la mejoría clínica frente a placebo (18 días frente a 23 días) en pacientes con una duración de los síntomas de 10 días o menos (HR 1,52; IC del 95 %: 0,95 a 2,43). Los autores exageran esto, pero no fue un criterio de valoración preespecificado y no está claro cómo se definió exactamente la mejoría clínica.
Conclusión del autor: “En este estudio de pacientes adultos ingresados en el hospital por COVID-19 grave, remdesivir no se asoció con beneficios clínicos estadísticamente significativos. Sin embargo, la reducción numérica en el tiempo hasta la mejora clínica en aquellos tratados antes requiere confirmación en estudios más amplios”.
Punto clínico para recordar: este ensayo clínico aleatorizado y de poca potencia de remdesivir frente a placebo no mostró significación estadística en ninguno de los resultados clínicos en pacientes con COVID-19. Sin embargo, a pesar de la falta de significación estadística, hubo tendencias hacia una duración más corta de la enfermedad y de la ventilación mecánica que requieren estudios adicionales en ensayos más grandes.
Resumen infográfico a través de Mark Ramzy, DO (Twitter: @MRamzyDO )

Referencias:
- Wang Y et al. Remdesivir en adultos con COVID-19 grave: un ensayo multicéntrico, aleatorizado, doble ciego y controlado con placebo. Lancet 2020. [ Publicación electrónica antes de la impresión ]
- Un ensayo clínico de los NIH muestra que Remdesivir acelera la recuperación del COVID-19 avanzado. NIAID 2020. [ Publicación electrónica antes de la impresión
Para obtener más información sobre este tema, consulte:
- PulmCrit: primer ECA controlado con placebo sobre Remdesivir para COVID-19
- First10EM: Remdesivir: la primera prueba real
- Conclusión: Remdesivir para COVID-19: un ECA
Publicación revisada por pares por: Anand Swaminathan, MD (Twitter: @EMSwami )
La publicaciónCOVID-19: Dos ensayos más recién publicados sobre Remdesivir apareció por primera vez en REBEL EM - Blog de medicina de emergencia .


