
 Antecedentes: Anteriormente había impartido una charla sobre el uso de trombolíticos en EP submasiva en el año 2016 . Este año tuve el privilegio de hablar nuevamente en ACOEP 2017 con una actualización sobre el paciente crítico con embolia pulmonar. Este post servirá como referencia para esa charla.
Antecedentes: Anteriormente había impartido una charla sobre el uso de trombolíticos en EP submasiva en el año 2016 . Este año tuve el privilegio de hablar nuevamente en ACOEP 2017 con una actualización sobre el paciente crítico con embolia pulmonar. Este post servirá como referencia para esa charla.
Hay muchas formas de clasificar la embolia pulmonar, pero la mejor definición clínica dependería de las consecuencias hemodinámicas. Por ejemplo, la embolia pulmonar masiva se puede definir como hipotensión sistémica (PAS < 90 mmHg o una caída de la PAS de al menos 40 mmHg durante al menos 15 minutos) o shock (hipoperfusión tisular, hipoxia, alteración del estado mental, oliguria o extremidades frías y húmedas). .) Hay un segundo subconjunto de pacientes que también merece discusión; embolia pulmonar submasiva. Estos pacientes se definen como ausencia de hipotensión sistémica (<90 mmHg), pero tienen disfunción/hipocinesia del ventrículo derecho. La disfunción del VD nos indica que existe una obstrucción grave de la arteria pulmonar y una insuficiencia hemodinámica inminente.
¿Cómo se define la PE submasiva en la literatura?
- EP aguda sin hipotensión (PAS <90 mmHg) pero con cualquiera de los siguientes:
- Disfunción del VD en POCUS
- Dilatación del VD (VD: diámetro del VI >0,9 en POCUS)
- BNP elevado (>500 pg/ml)
- Troponina I elevada (>0,4 ng/ml)
- Troponina T elevada (>0,1 ng/ml)
- Nuevos cambios en el ECG (BRD completo o incompleto, elevación/depresión del segmento ST anteroseptal o inversión de la onda T anterolateral)
¿Cuáles son algunas formas de definir la disfunción del VD en la ecocardiografía?
- Diámetro telediastólico VD/VI >1 en vista apical de 4 cámaras
- Diámetro telediastólico del VD > 30 mm
- Movimiento sistólico septal paradójico
- Signo de McConnell: Acinesia de la pared libre del VD respetando el ápice; Se ha demostrado que tiene una especificidad del 94% y una sensibilidad del 77% para diagnosticar EP [4]
¿Qué pasa con los marcadores sustitutos de disfunción del VD?
Ningún valor de laboratorio por sí solo puede usarse para hacer un diagnóstico de EP masiva o submasiva, pero cuando se suman pueden ayudar a aumentar la probabilidad previa a la prueba y determinar el pronóstico.
- ECG: Ningún hallazgo es muy sensible o específico; taquicardia sinusal, patrón histórico S1Q3T3, inversiones de la onda T precordial (V1 – V4), nuevo bloqueo de rama derecha (completo o incompleto)
- Niveles elevados de troponina: asociados con peor pronóstico; O 5,90 [7]
- BNP elevado: asociado con peor pronóstico; O 9,51 [8]
¿Por qué es importante identificar a los pacientes con EP masiva y submasiva?
Al revisar grandes ensayos de registro, la mortalidad a 30 días por EP es aproximadamente del 3% [9 – 11]. La hipotensión y la disfunción del VD en el contexto de una embolia pulmonar aguda se asocian con un aumento de la mortalidad [2].

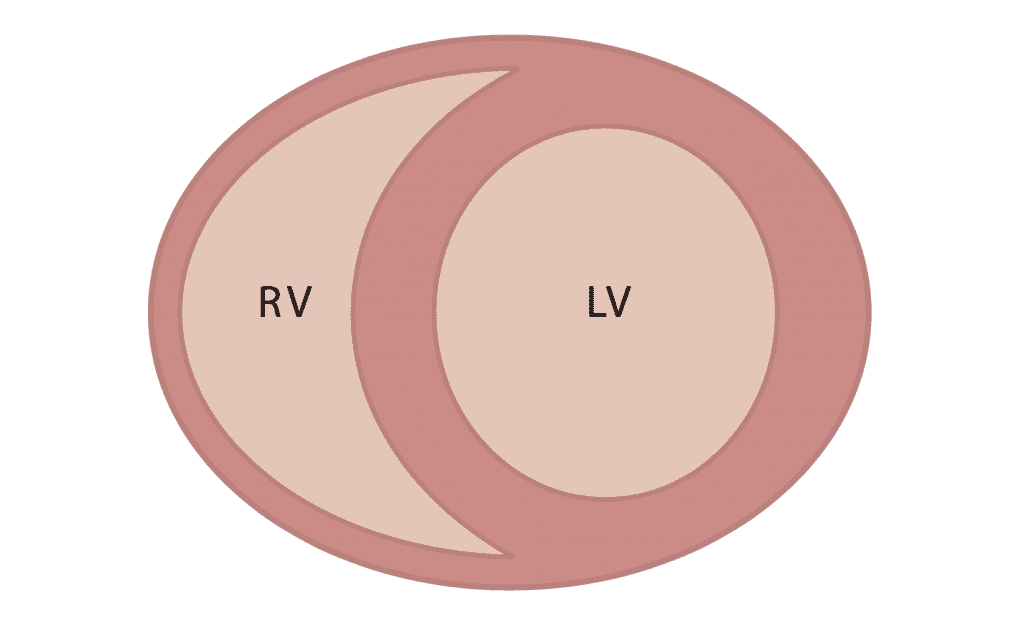
El ventrículo derecho no es como el ventrículo izquierdo:
El VD tiene una geometría en forma de media luna, con fibras dispuestas en serie (en lugar de paralelas como el VI), y la pared libre del VD es delgada con una baja relación volumen-superficie, lo que lo hace poco tolerante a elevaciones agudas en la poscarga. La función sistólica del VD también es diferente en que la contracción sistólica ocurre en 3 fases: contracción del músculo papilar, movimiento hacia adentro de la pared libre del VD y, finalmente, contracción del VI que causa el desplazamiento medial del tabique interventricular hacia el VD. Esta fase final es importante ya que una reanimación excesiva con líquidos puede hacer que el tabique interventricular se incline hacia el VI.
Reanimación inicial
La obstrucción aguda del flujo de salida del VD provoca insuficiencia circulatoria aguda, que es la principal causa de muerte en pacientes con EP submasiva y masiva. Por tanto, la estabilización inicial debe centrarse en el apoyo hemodinámico. Tampoco debemos olvidarnos de la hipoxia y la hipercapnia:
- Hipoxia e hipercapnia: queremos evitar la hipoxia y la hipercapnia, ya que pueden provocar vasoconstricción pulmonar. En pacientes con EP, el coágulo en las arterias pulmonares puede crear una fisiología de derivación debido a la falta de intercambio de gases. La PEEP hace un buen trabajo reclutando alvéolos atelectásicos y, por tanto, mejorando el intercambio de gases (y, por tanto, la hipoxia) en los pulmones. Queremos intentar evitar la intubación, ya que esto disminuirá la precarga del VD a medida que pasamos de la ventilación con presión negativa a la ventilación con presión positiva, lo que aumenta las presiones intratorácicas. Otras opciones aquí incluyen:
- CNAF
- BiPAP/CPAP
- BVM - Reclutamiento de CPAP para apnea
-
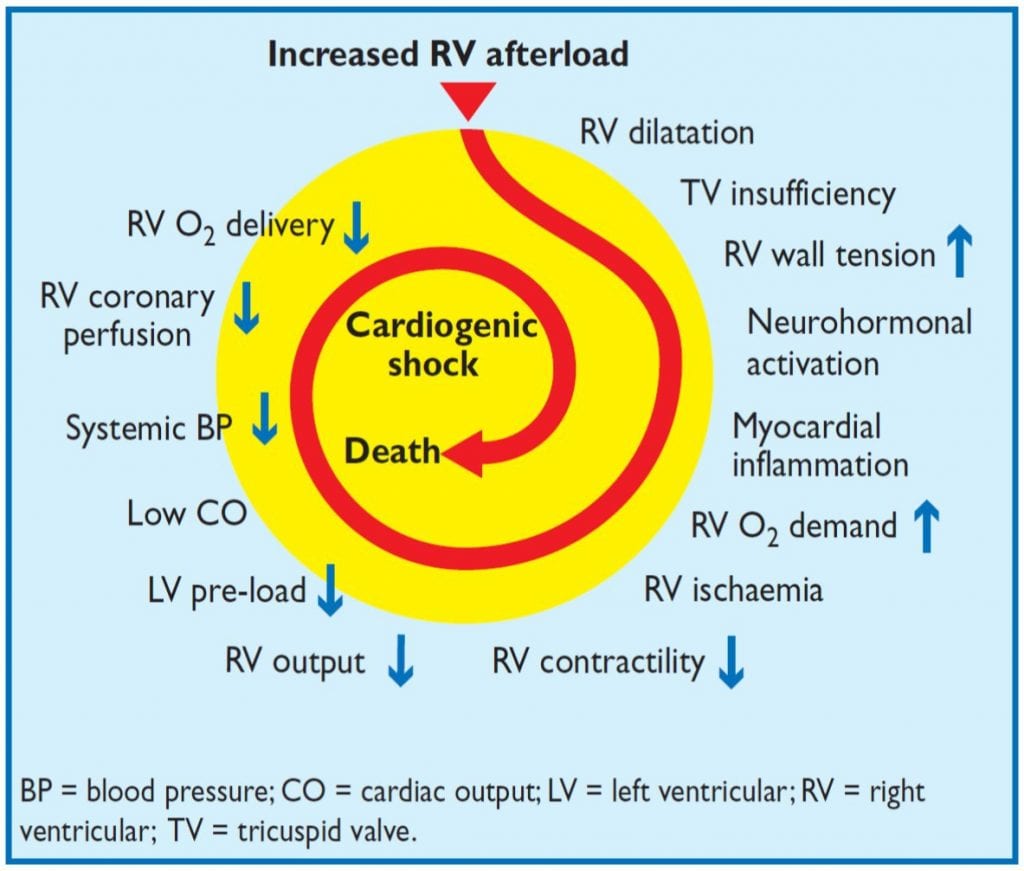
Expansión de volumen: normalmente, en el shock indiferenciado se infunden entre 1 y 2 litros de cristaloide; sin embargo, en el paciente con EP crítico esto puede causar un aumento adicional de la presión del VD, lo que puede conducir a una disminución de la presión de perfusión coronaria del VD, lo que resulta en isquemia del VD. En estos pacientes realmente queremos limitar la cantidad de líquidos que estamos infundiendo.
- La espiral de la muerte: aumento de la poscarga del VD (EP aguda) à FIV à aumento de la tensión de la pared del VD –> aumento de la demanda de O2 del VD –> aumento de la isquemia del VD –> disminución de la contractilidad del VD –> disminución de la precarga del VI –> disminución de CO –> disminución de la presión de perfusión coronaria del VD –> Shock Cardiogénico à Muerte
- Vasopresores e inotrópicos: el uso temprano de vasopresores e inotrópicos puede ayudar a mejorar la función del VD. La norepinefrina sería un agente ideal ya que ayuda a aumentar la PAM y mejorar la función del VD, sin aumentar las presiones vasculares pulmonares. La dobutamina y la milrinona pueden ayudar a mejorar la función del VD y el gasto cardíaco al tiempo que disminuyen la resistencia vascular pulmonar. El principal problema con estos agentes es que son vasodilatadores y pueden empeorar la hipotensión y deben usarse junto con vasopresores.
- Vasodilatadores pulmonares: el óxido nítrico (NO) inhalado es muy prometedor en el tratamiento de la insuficiencia del VD. Fisiológicamente, disminuye la resistencia vascular pulmonar sin reducir las presiones sistémicas. También parece mejorar el desajuste entre ventilación y perfusión.
- Resumen de reanimación inicial: terapia progresiva: comience con una hidratación suave (500 ml), luego considere la adición temprana de un vasopresor, seguido de un inotrópico. Si el paciente todavía está hemodinámicamente inestable, considere agregar NO inhalado.

Administración medica:
Este es el elefante en la habitación. ¿Cuándo debemos considerar iniciar trombolíticos, qué dosis y cómo debemos administrar la anticoagulación?
- Trombólisis: para simplificar, dividiré esto en tratamiento masivo y submasivo.

PE masiva: los trombolíticos cuentan con el respaldo de varias organizaciones internacionales como terapia de primera línea (ACCP, AHA, EHA y ACEP)
- Wan et al 2004: Metanálisis de 11 ensayos con 748 pacientes. ECA de trombólisis + anticoagulación versus placebo + anticoagulación. Hubo una reducción en la EP recurrente o la muerte (9,4% frente a 19,0%; NNT = 10 ) con el riesgo de aumento de hemorragia mayor (21,9% frente a 11,9%; NNT = 10 )
- Ensayo PEAPETT 2016: Serie de casos de un solo centro de 23 pacientes con PEA y paro cardiopulmonar debido a EP confirmada. Todos los pacientes recibieron 50 mg de tPA en inyección intravenosa durante 1 minuto. ROSC se logró en 22/23 pacientes y 20/23 (87%) seguían vivos a los 2 años de seguimiento. Sin sangrado mayor o menor.
- Wang C et al 2010: ECA prospectivo de 118 pacientes con inestabilidad de la EH u obstrucción masiva de la arteria pulmonar administraron 50 mg/2 h de t-PA frente a 100 mg/2 h de tPA. No hubo diferencias en la obstrucción de la arteria pulmonar, la EP recurrente o la muerte, y con la mitad de la dosis de trombolíticos se redujo el sangrado mayor (3% frente a 10%).
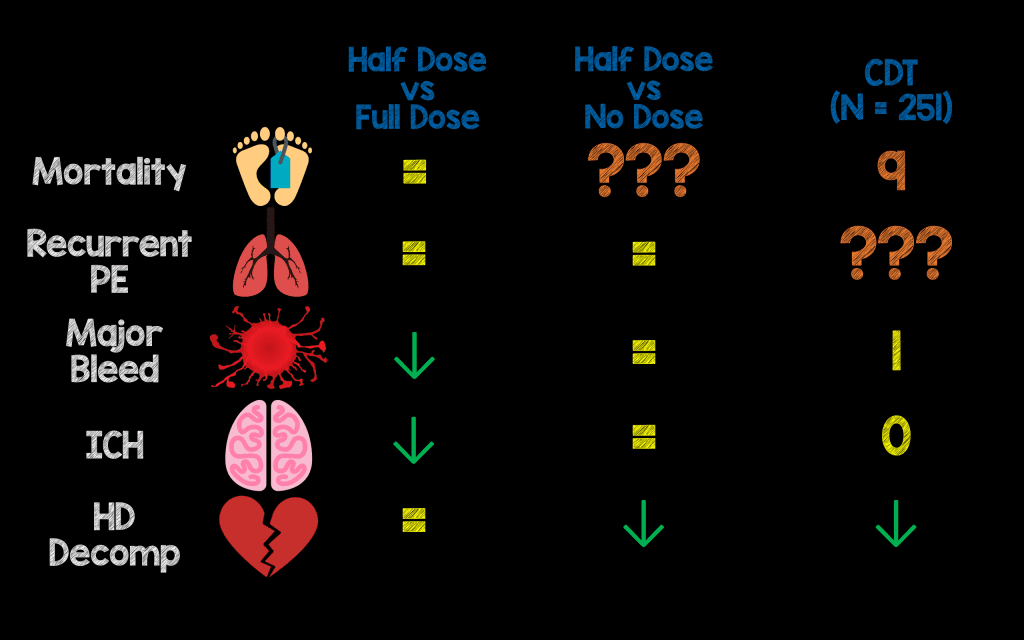
PE masivo CONCLUSIÓN FINAL: rt-PA 50 mg durante 2 horas ha demostrado una eficacia similar a 100 mg durante 2 horas en resultados clínicos con un mejor perfil de seguridad (menos sangrado)
PE submasiva: terapia trombolítica controvertida y confusa. El motivo de la controversia es que los beneficios sobre la mortalidad han sido mixtos entre los estudios, mientras que existe una tasa real de HIC del 2 al 3% con la trombólisis. Además, no se han realizado comparaciones directas de los agentes trombolíticos para ayudar a seleccionar uno sobre otro. Las organizaciones internacionales ni siquiera pueden ponerse de acuerdo sobre las recomendaciones:

-
Trombólisis de dosis completa:
- MAPPET-3 2002: 256 pacientes asignados al azar a alteplasa + heparina versus placebo versus heparina. El criterio de valoración principal fue compuesto de muerte hospitalaria o deterioro clínico. No hubo diferencias en la mortalidad, pero sí una disminución del deterioro hemodinámico ( NNT = 7 ) y, curiosamente, no hubo diferencias en las hemorragias mayores en este estudio.
- TOPCOAT 2014: 83 pacientes con EP submasiva asignados aleatoriamente a tenecteplasa + heparina versus placebo + heparina. El criterio de valoración principal fue compuesto de muerte y necesidad de intubación o trombectomía quirúrgica entre 5 y 6 semanas. Nuevamente, no hubo mejoría en la mortalidad con un aumento de la HIC (2,5 % frente a 0 %; NND = 40 ). Hubo algunos resultados sustitutos que mejoraron, entre ellos: calidad de vida, función del VD y capacidad de ejercicio a los 90 días.
- Ensayo PEITHO (2014): ECA más grande hasta la fecha; Se aleatorizó a 1.006 pacientes con PAS normal y RVD y troponina elevada a heparina y tenecteplasa o placebo y heparina. El resultado primario fue el criterio de valoración compuesto de muerte por cualquier causa o descompensación hemodinámica. El resultado primario se produjo en el 2,6 % de los pacientes del grupo de tenecteplasa y en el 5,6 % de los pacientes del grupo de placebo ( NNT = 30 ). Este resultado fue impulsado predominantemente por la descompensación hemodinámica y no por la mortalidad. El beneficio hemodinámico se produjo a expensas del aumento de las hemorragias mayores (11,5 % frente a 2,4 %; NNH = 20 ) y de la HIC (2,4 % frente a 0,2 %; NNH = 46 )
- Chaterjee et al Metanálisis de 2014: 8 ensayos con 1775 pacientes con EP de riesgo submasivo/intermedio. La mortalidad por todas las causas disminuyó con la trombólisis (1,39% frente a 2,92%; NNT = 65 ), pero nuevamente a expensas de hemorragias graves (7,74% frente a 2,25%; NND = 18 ) y HIC (1,46 frente a 0,19%; NND = 78 )
- Seguimiento a largo plazo de PEITHO 2017: seguimiento del ensayo PEITHO original con 709 pacientes seguidos durante una mediana de 37,8 meses. No hubo diferencias en la mortalidad o morbilidad (disnea residual, limitaciones funcionales y disfunción persistente del VD).
- Trombólisis de dosis completa CONCLUSIÓN FINAL: Los datos sobre el beneficio en mortalidad son contradictorios, pero hay una disminución significativa en la descompensación hemodinámica, pero a costa de un aumento de las hemorragias graves y de la HIC.
- Trombólisis de media dosis:
- Levine et al 1990: 58 pacientes asignados al azar a 0,6 mg/kg (máximo de 50 mg) de alteplasa frente a heparina sola. El resultado primario fue la carga de coágulos en la exploración V/Q a los 7 y 28 días. Disminución de la carga de coágulos sin hemorragia importante en ninguno de los grupos. No se evaluó la mortalidad
- Ensayo MOPPET 2013: 121 pacientes con EP submasiva asignados al azar a una dosis reducida de rt-PA de 50 mg para pacientes ≥50 kg y 0,5 mg/kg para aquellos que pesaban <50 kg. Hubo una reducción en el resultado primario de hipertensión pulmonar definida por ETT a los 28 meses (16% frente a 57%; NNT = 2 ) y una reducción en el criterio de valoración combinado de muerte más EP recurrente (1,6% frente a 10%; NNT = 12 ). No hubo hemorragia importante ni HIC en ninguno de los grupos.
- Trombólisis de ½ dosis CONCLUSIÓN FINAL: Mejora los resultados sustitutos (es decir, la mortalidad no es el resultado primario en ninguno de los estudios) y el beneficio adicional de menos hemorragias graves o HIC.
Trombólisis de dosis completa versus media dosis:
- Metanálisis de Zhang et al 2014: 5 ECA con 444 pacientes, pero solo 3 ensayos compararon la dosis completa con la mitad de la dosis de trombolíticos (100 mg de alteplasa frente a 0,6 mg/kg, dosis máxima: 50 mg). No hubo diferencias en la mortalidad ni en la EP recurrente, pero hubo más hemorragias graves con la dosis completa de trombolíticos (4,3 % frente a 11,1 %; NND = 15 )
- Se han realizado 8 ensayos que estudiaron media dosis de alteplasa en EP con 453 pacientes. En la revisión de estos estudios solo se ha documentado una HIC (1/453 = 0,2%).

- Finalmente, nunca he entendido realmente por qué administramos anticoagulación antes, durante o inmediatamente después de la trombólisis. Esto parece una ecuación para problemas (anticoagulación + trombólisis = MALO). En lugar de eso, mantendría la anticoagulación antes y durante la trombólisis y no la iniciaría hasta 2 a 3 horas después de la trombólisis e incluso consideraría administrar una dosis reducida.

-
Sin trombólisis (anticoagulación sola):
- Metanálisis de Zhang et al 2014: 5 ECA con 444 pacientes, pero dos ensayos compararon dosis bajas de 0,6 mg/kg (dosis máxima 50 mg/2 h) o 10 mg en bolo + ≤40 mg/2 h frente a heparina por goteo sola. No hubo diferencias en los eventos hemorrágicos mayores, la EP recurrente o la mortalidad por todas las causas.
- Metanálisis de Xu Q et al 2015: Dreampanerai 7 ensayos con 1631 pacientes que compararon líticos en dosis completa versus media dosis de líticos, versus anticoagulación sola. Dado que los ensayos de media dosis de líticos no evaluaron realmente la descompensación hemodinámica, tenemos que utilizar los ensayos de dosis completa. En los ensayos de dosis completa versus heparina, hubo más descompensación hemodinámica en los brazos de anticoagulación sola (14,1% versus 8,4%; NND = 18 ).
- Sin trombólisis En conclusión: en pacientes con EP submasiva, la anticoagulación sola produce una mayor descompensación hemodinámica.
-
Trombolíticos dirigidos por catéter (CDT):
- Ensayo SEATTLE-2 2015 : ensayo prospectivo de un solo grupo sobre el tratamiento de la EP aguda (31 EP masiva y 119 EP submasiva). El resultado primario fue la relación VD/VI a las 48 horas. El tratamiento disminuyó la dilatación del VD y la hipertensión pulmonar con cero casos de HIC. Hubo una hemorragia importante, que fue un hematoma en la ingle que resultó en hipotensión transitoria. Los beneficios en este estudio se produjeron en un mayor costo y duración de la estancia hospitalaria (8,8 días +/- 5)
- Ensayo PERFECT 2015: estudio prospectivo de un solo grupo de 101 pacientes con EP aguda (28 EP masiva y 73 EP submasiva). En este ensayo hubo menos descompensación hemodinámica y no hubo casos de HIC ni de hemorragia mayor.
- Terapia dirigida por catéter Conclusión: La evidencia de la terapia dirigida por catéter proviene de estudios de un solo grupo sin comparación con la trombólisis sistémica o el placebo. Es más caro y provoca una estancia más prolongada en la UCI. Esta puede ser una opción en pacientes con mayor riesgo de HIC o hemorragia grave (es decir, pacientes >65 años de edad).
Mi resumen de trombólisis en EP submasiva:
Manejo Quirúrgico (No cubierto en mi charla):
- Debe considerarse en pacientes con EP masiva con contraindicaciones para la trombólisis o sin respuesta a la trombólisis.
- Embolectomía quirúrgica: limitada a grandes centros médicos con cirujanos experimentados y capacidades de derivación cardiopulmonar.
Filtro de Vena Cava Inferior (Tampoco lo cubrí en mi charla):
- La literatura se compone principalmente de series de casos e informes de casos. Estos ensayos mostraron una reducción temprana de la EP recurrente pero con un aumento tardío de la TVP recurrente. La única indicación real para la colocación de filtros es la contraindicación del tratamiento anticoagulante.
- Ensayo PREPIC 1998: 400 pacientes con TVP proximal aguda asignados aleatoriamente a filtro intravenoso + anticoagulación frente a coagulación sola. A los 12 días, la colocación del filtro dio como resultado una reducción absoluta del 4% en la incidencia de EP, pero una duplicación del riesgo de TVP recurrente a los 2 años (10% sin filtro versus 20% con filtro).
Puntos clínicos para llevar a casa:
- Tenga cuidado con la reanimación con demasiado volumen, ya que esto puede causar descompensación hemodinámica en pacientes con EP submasivas/masivas agudas.
- Considere comenzar con vasopresores/inotrópicos más temprano que tarde.
- En la EP masiva, la mitad de la dosis de trombolíticos parece ser tan eficaz como la dosis completa de trombolíticos con menos sangrado.
- La EP submasiva es un espectro de enfermedades. No todos los pacientes necesitarán trombolíticos, pero si los necesitan, considere la posibilidad de tomar media dosis de trombolíticos.
- Mantener la anticoagulación antes y durante la trombólisis y no iniciarla hasta 2 a 3 horas después de la trombólisis para disminuir el riesgo de hemorragia grave e HIC.
- En pacientes con mayor riesgo de hemorragia o HIC (es decir, edad ≥65), los trombolíticos dirigidos por catéter (TDC) pueden ser una opción (esto dependerá de la institución)
- En pacientes que tienen contraindicaciones para los trombolíticos o la anticoagulación, considerar la embolectomía quirúrgica (esto dependerá de la institución)
- La única función de los filtros de la vena cava inferior es la contraindicación del tratamiento anticoagulante.
Referencias:
- Sekhri V et al. Manejo de la embolia pulmonar masiva y no masiva. Arch Med Sci 2012. PMCID: PMC3542486
- Kasper y cols. Estrategias de manejo y determinantes del resultado en embolia pulmonar aguda mayor: resultados de un registro multicéntrico JACC 1997. PMID: 9350909
- Matthews JC y cols. Insuficiencia aguda del ventrículo derecho en el contexto de embolia pulmonar aguda o hipertensión pulmonar crónica: una revisión detallada de la fisiopatología, el diagnóstico y el tratamiento. Curr Cardiol Rev 2008. PMCID: PMC2774585
- McConnell MV y cols. Disfunción regional del ventrículo derecho detectada por ecocardiografía en embolia pulmonar aguda Am J Cardiol 1996. PMID: 8752195
- Meyer G et al. Avances recientes en el tratamiento de la embolia pulmonar: enfoque en los pacientes críticamente enfermos. Ann Cuidados Intensivos 2016. PMID: 26934891
- Jaff MR et al. Manejo de la embolia pulmonar masiva y submasiva, la trombosis de la vena profunda iliofemoral y la hipertensión pulmonar tromboembólica crónica: una declaración científica de la Asociación Estadounidense del Corazón. Circulación 2011. PMID: 21422387
- Becattini C et al. Valor pronóstico de las troponinas en la embolia pulmonar aguda: un metanálisis. Circulación 2007. PMID: 17606843
- Sánchez O et al. Valor pronóstico de la disfunción del ventrículo derecho en pacientes con embolia pulmonar hemodinámicamente estable: una revisión sistemática. Eur Corazón J 2008. PMID: 18495689
- Pollack CV y cols. Características clínicas, manejo y resultados de pacientes diagnosticados con embolia pulmonar aguda en el departamento de emergencias: informe inicial de EMPEROR (Registro multicéntrico de embolia pulmonar de medicina de emergencia en el mundo real). JACC 2011. PMID: 21292129
- Lobo JL et al. Síndromes clínicos y resultados clínicos en pacientes con embolia pulmonar: hallazgos del registro RIETE. PECHO 2006. PMID: 17167002
- Schissler AJ et al. Tendencias nacionales en el diagnóstico de embolia pulmonar en salas de emergencia, 2011 – 2010: un estudio transversal. Respir Res 2015. PMCID: PMC4391335
Para obtener más ideas sobre este tema, consulte:
- Josh Farkas en PulmCrit (EMCrit): Submassive PE 2017 – Sacándolos del precipicio
- Josh Farkas en PulmCrit (EMCrit): Ocho perlas para el paciente con EP masiva que sufre un accidente
- Salim Rezaie en REBEL EM: Tratamiento de la embolia pulmonar submasiva (EP): ¿dosis completa, media dosis o ninguna dosis?
- Anand Swaminathan en el blog de St. Emlyn: El argumento a favor de los trombolíticos sistémicos en la embolia pulmonar submasiva
Publicación revisada por pares por: Anand Swaminathan (Twitter: @EMSwami )
La publicación El paciente crítico con embolia pulmonar apareció por primera vez en REBEL EM - Blog de medicina de emergencia .
