
 Descargo de responsabilidad: esta publicación explora algunos de los hallazgos fisiopatológicos en la infección grave por SARS-CoV-2. Explora posibles mecanismos basados y postula teorías, PERO, esta no es una publicación clínica. La hipótesis y los hallazgos aquí no están confirmados y la extrapolación al manejo no está clara.
Descargo de responsabilidad: esta publicación explora algunos de los hallazgos fisiopatológicos en la infección grave por SARS-CoV-2. Explora posibles mecanismos basados y postula teorías, PERO, esta no es una publicación clínica. La hipótesis y los hallazgos aquí no están confirmados y la extrapolación al manejo no está clara.
Es muy necesario comprender los mecanismos de la COVID-19 si queremos encontrar tratamientos que puedan ser beneficiosos. La principal causa de mortalidad en pacientes con COVID-19 es la insuficiencia respiratoria hipoxémica que con mayor frecuencia provoca SDRA. Sin embargo, se desconocen los mecanismos que llevan a los pacientes de la infección al SDRA: ¿es daño alveolar difuso (DAD), daño endotelial o alguna combinación de ambos? Aunque puede parecer ridículo considerar estas dos entidades como separadas, ya que la interfaz alveolar-capilar tiene un tamaño submicrónico, queremos saber si una de estas dos entidades está provocando la lesión más que la otra. Se han publicado algunos informes patológicos interesantes que analizan la histopatología de COVID-19 y muchas más discusiones sobre las similitudes con otras neumonías virales (es decir, H1N1). Una publicación reciente en NEJM compara la patología del COVID-19 con la del H1N1.
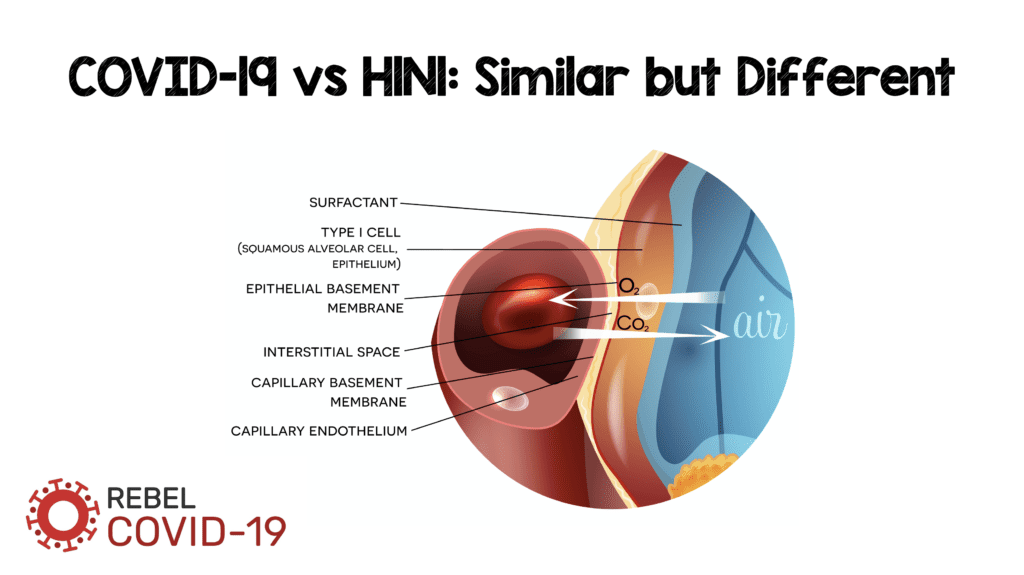
A continuación se muestra una imagen de Teuwen LA et al [2] que muestra una interfaz normal y anormal entre el alvéolo y las células endoteliales.
La imagen de arriba prepara el escenario para analizar varios mecanismos potenciales de lesión. En el resto de la publicación revisaremos un estudio patológico que compara las características morfológicas de los pulmones de COVID-19, H1N1 y casos compatibles. Aunque el modelo de Teuwen LA et al es un modelo propuesto de fuga vascular, coagulación, inflamación y angiogénesis, la publicación de Ackermann M et al [1] nos muestra cómo el H1N1 y el COVID-19 son similares, pero diferentes.
Artículo: Ackermann M et al. Endotelialitis vascular pulmonar, trombosis y angiogénesis en COVID-19. NEJM 2020. [ Publicación electrónica antes de la impresión ]
Que hicieron:
- Estudio de autopsia de:
- Pacientes fallecidos por COVID-19: 7 pulmones
- Pacientes que murieron por SDRA secundario a A(H1N1): 7 pulmones (tejido pulmonar archivado de la pandemia de 2009)
- Pulmones de control no infectados y de la misma edad: 10 pulmones
- Todos los pulmones fueron estudiados con diversas formas de análisis.
Histología del síndrome de dificultad respiratoria aguda (SDRA)
- Daño alveolar difuso (DAD) con edema, hemorragia y depósito de fibrina intraalveolar
- La DAD es un hallazgo inespecífico y puede ocurrir por muchas causas posibles, tanto infecciosas como no infecciosas.
- Las versiones de DAD para SARS-CoV y SARS-CoV-2 también incluyen informes de trombos de fibrina
Peso medio de los pulmones:
- H1N1 > COVID-19 > Controles combinados
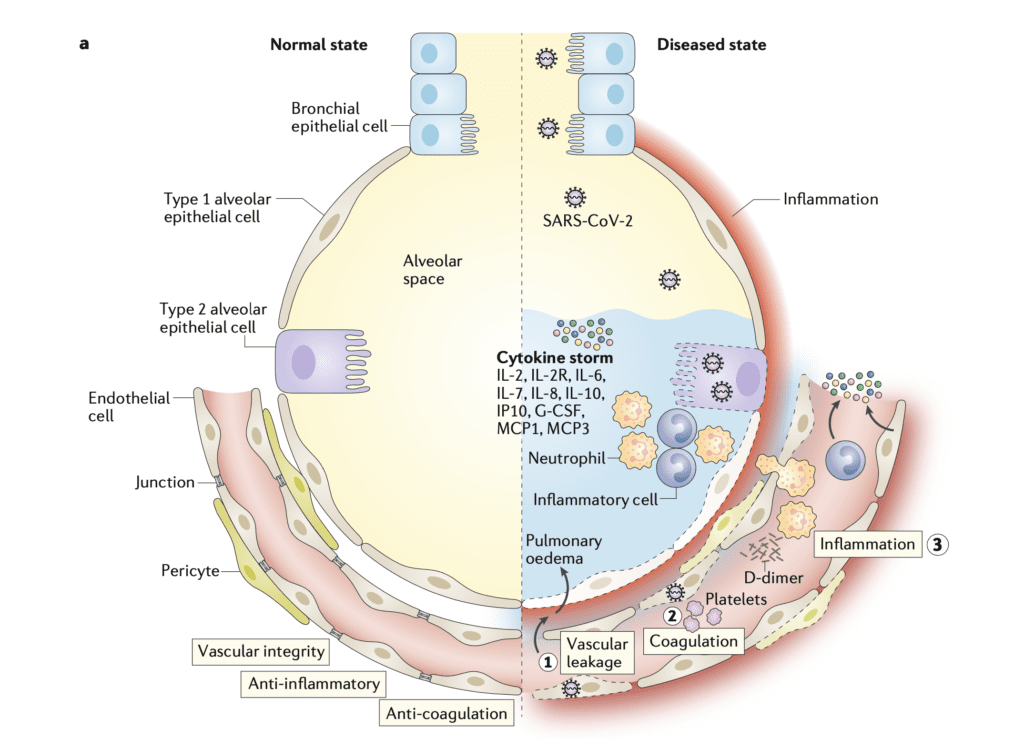
- El aumento de peso de los pulmones en COVID-19 y H1N1 se debe probablemente a fugas vasculares y edema pulmonar. Teuwen LA et al [2] describen algunos de los posibles mecanismos para esto:
- El virus puede afectar directamente a las células endoteliales provocando endotelitis, lisis y muerte.
- El SARS-CoV-2 se une a los receptores ACE2, lo que perjudica su actividad mediante una regulación negativa o una eliminación. La actividad reducida de ACE2 activa indirectamente las vías de calicreína-bradicinina que aumentan la permeabilidad vascular
- Los neutrófilos activados producen mediadores histotóxicos (es decir, especies reactivas de oxígeno)
- Las células inmunes, las citocinas inflamatorias y las moléculas vasoactivas aumentan la contractilidad endotelial y aflojan las uniones interendoteliales, lo que genera espacios.
- IL-1B y TNF activan las glucuronidasas que degradan el glicocálix y regulan positivamente la ácido hialurónico sintasa 2, lo que aumenta la deposición de ácido hialurónico en la matriz extracelular y promueve la retención de líquidos.
- El efecto neto de todos estos mecanismos es un aumento de la permeabilidad vascular y la fuga vascular.
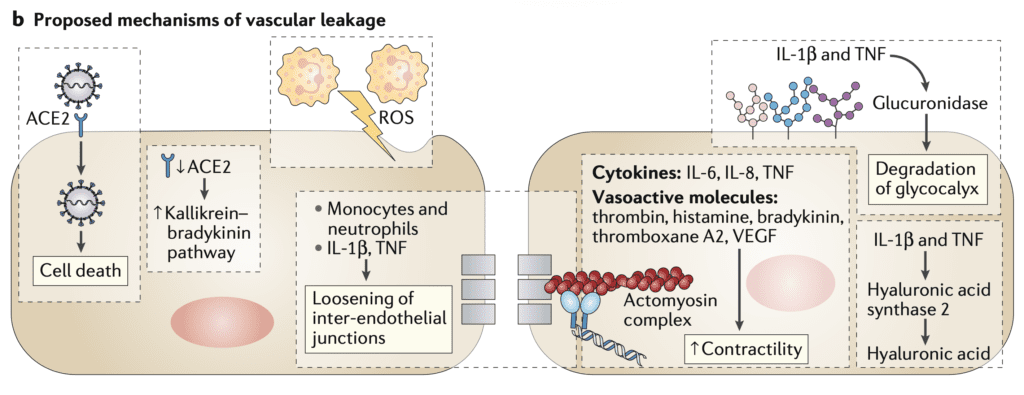
Mecanismo propuesto de fuga vascular (Imagen de [2]
Inflamación angiocéntrica
- Tanto el COVID-19 como el H1N1 tenían DAD con necrosis de las células del revestimiento alveolar y depósito de fibrina intraalveolar.
- COVID-19: Los cambios fueron más focalizados en la mayoría de los casos y solo tuvieron un leve edema intersticial
- H1N1: Los cambios fueron más difusos con edema intersticial masivo y depósito extenso de fibrina en todos los casos.
- Esto ayuda a explicar el mayor peso de los pulmones con el H1N1 en comparación con el COVID-19
- Expresión media de la enzima convertidora de angiotensina 2 (ACE2) (células positivas para ACE2 por campo de visión):
- Hay significativamente más células positivas para ACE2 en las células endoteliales capilares que en las células epiteliales alveolares tanto en COVID-19 como en H1N1.
- Además, se observaron linfocitos ACE2 positivos en el tejido perivascular y en los alvéolos tanto en COVID-19 como en H1N1.
- El aumento de la inflamación vascular está presente tanto en COVID-19 como en H1N1, sin embargo, parece ser más predominante en las células endoteliales capilares (esto explica el aumento de IM, accidentes cerebrovasculares, EP, etc. observado en ambas enfermedades).
Trombosis y microangiopatía
- Se pudieron observar microtrombos de fibrina en los capilares alveolares de todos los pulmones tanto por COVID-19 como por H1N1
- Los microtrombos capilares alveolares fueron 9 veces más prevalentes en pacientes con COVID-19 que con H1N1
- Los autores también realizaron una microCT tridimensional de las muestras pulmonares, lo que confirmó los hallazgos histológicos de que tanto el COVID-19 como el H1N1 mostraban oclusiones de los vasos precapilares y poscapilares.
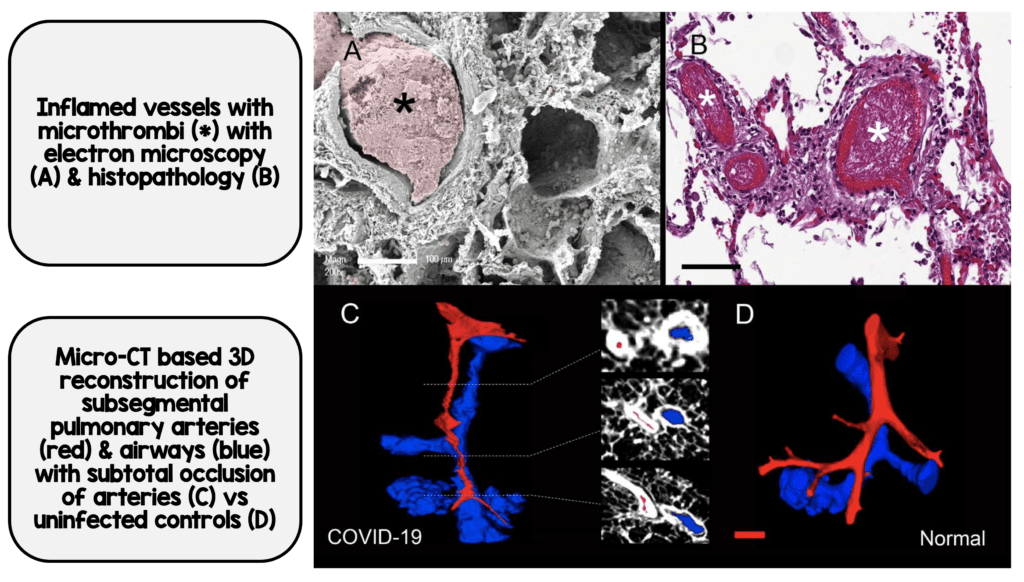
Trombosis asociada a COVID-19 (Imagen de [1])
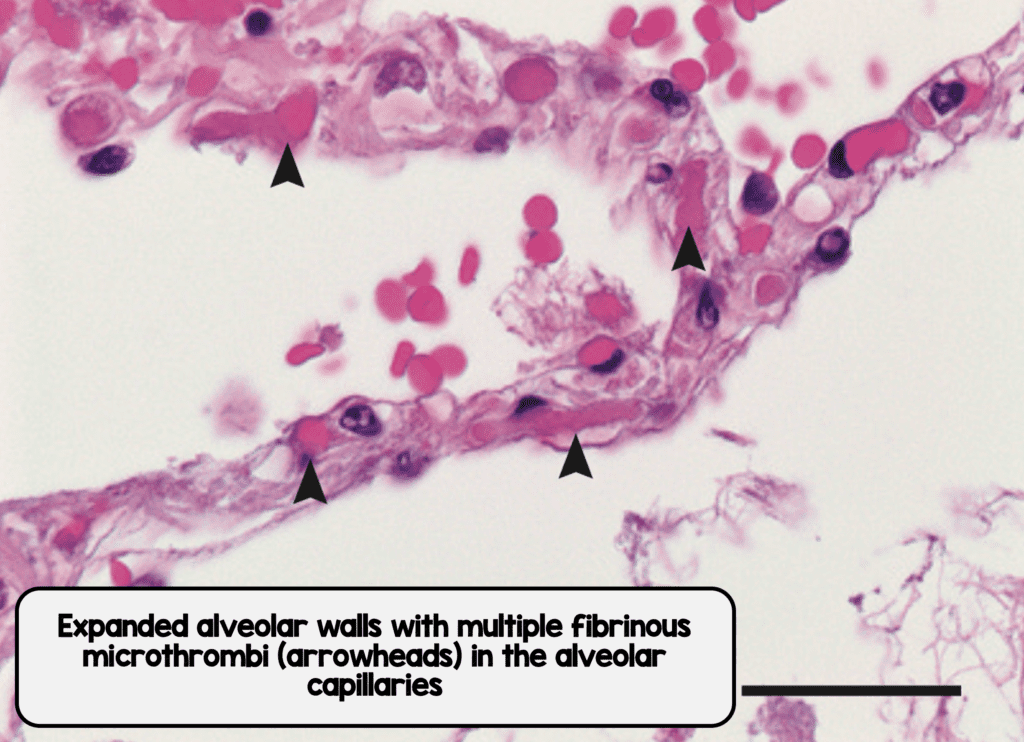
Microtrombos en tabiques interalveolares por COVID-19 (Imagen de [1]
- Teuwen LA et al [2] proponen un conjunto de mecanismos de por qué vemos tanta trombosis en COVID-19
- La alteración de la integridad vascular y la muerte de las células endoteliales conducen a la exposición de la membrana basal trombogénica. Esto luego activa la cascada de coagulación.
- IL-1B y TNF aumentan la expresión de la selección P, el factor von Willebrand y el fibrinógeno (estos son a lo que se unen las plaquetas)
- Las células endoteliales liberan citocinas tróficas que pueden aumentar la producción de plaquetas. Las plaquetas liberan VEGF, que activa las células endoteliales para regular positivamente el factor tisular (principal activador de la cascada de coagulación)

Mecanismos propuestos para el inicio de la coagulación (imagen de [2])
- Tanto los pulmones de COVID-19 como los de H1N1 tenían microtrombos presentes en las vénulas precapilares, capilares alveolares y poscapilares de diversos grados, pero se observó una prevalencia significativamente mayor en COVID-19 en los capilares alveolares (esto podría explicar por qué la profilaxis estándar la anticoagulación puede no funcionar en algunos pacientes)
Angiogénesis
- COVID-19: Vascularidad distorsionada con capilares estructuralmente deformados. Capilares alargados con cambios bruscos de calibre y pilares intususceptivos dentro de los capilares. Daño ultraestructural al endotelio con SARS-CoV-2 intra y extracelular
- La densidad media de características angiogénicas intususceptivas y de brotes fue mayor en COVID-19 que en H1N1
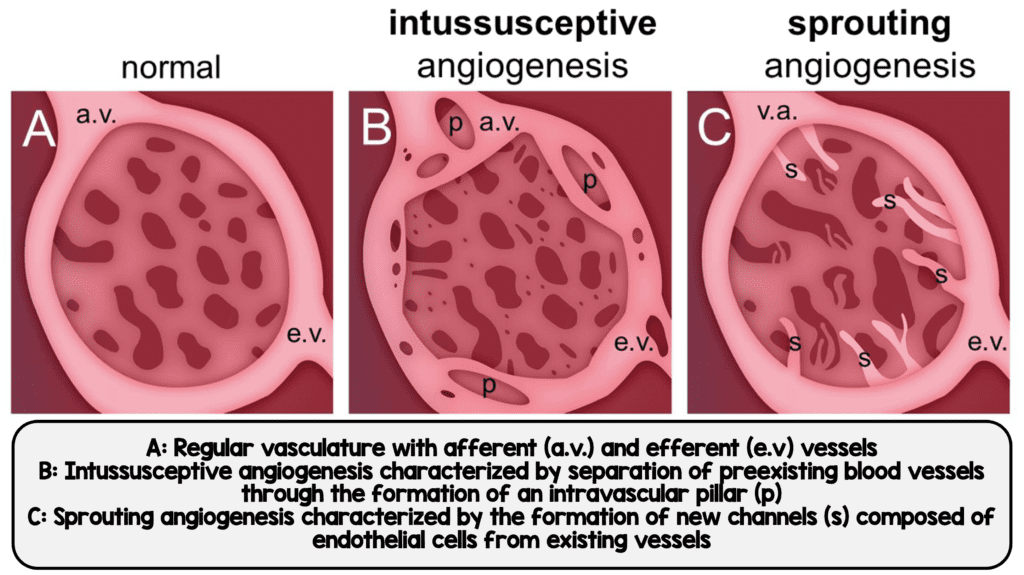
Angiogénesis intususceptiva y por brotes observada en COVID-19 (Imagen de [1])

Micrografías electrónicas que muestran alteraciones microvasculares en los pulmones por COVID-19 (imagen de [1])
- Teuwen LA et al [2] proponen que debido al aumento de la microtrombosis observado con COVID-19, comienza a desarrollarse isquemia del tejido pulmonar, lo que desencadena la angiogénesis y la hiperplasia de las células endoteliales.
- Recuentos angiogénicos pulmonares frente a duración de la estancia hospitalaria
- La angiogénesis intususceptiva y la angiogénesis por brotes fueron significativamente más profundas en comparación con el H1N1 y los controles equivalentes (ver imagen a continuación)

Densidad de las características angiográficas intususceptivas y de brotes de COVID-19, H1N1 y controles combinados (Paneles A y B) y frente al tiempo de hospitalización (Paneles C y D) (Imagen de [1])
- Se observa un aumento de las características angiográficas intususceptivas y de brotes tanto en COVID-19 como en H1N1; sin embargo, la densidad de estas características es significativamente mayor en COVID-19 (esto generalmente se debe a la hipoxia y los factores de crecimiento).
Limitaciones importantes:
- Una limitación importante de este estudio es que ninguno de los pacientes con COVID-19 recibió ventilación mecánica, mientras que 5 de 7 pacientes en el grupo H1N1 sí lo fueron.
- Las diferencias en la angiogénesis también podrían deberse a la diferente evolución temporal de la COVID-19 y la gripe que no se puede controlar en este tipo de ensayo.
Resumen de resultados:
- Los pulmones de los pacientes con COVID-19 y H1N1 tienen algunas similitudes superpuestas y algunas diferencias importantes:
- Ambas enfermedades presentan DAD y linfocitos perivasculares infiltrantes y un mayor número de células ACE-2 positivas en los pulmones (Predominantemente en las células endoteliales capilares)
- Sin embargo, el COVID-19 se diferencia del H1N1 en varios aspectos distintos:
- Lesión endotelial grave con membranas celulares endoteliales alteradas
- Trombosis vascular generalizada con microangiopatía y oclusión de capilares alveolares (9 veces más prevalente en comparación con el H1N1)
- Mayor crecimiento de nuevos vasos (angiogénesis intususceptiva y brotante)
Pensamientos adicionales:
- Sabemos que los pacientes mayores, obesos, hipertensos y diabéticos tienen mayor riesgo de sufrir una enfermedad más grave. ¿Por qué podría ser esto? ¿Qué tienen todos en común?… Todos se caracterizan por una disfunción vascular preexistente y un metabolismo de las células endoteliales alterado.
Línea de fondo:
- Ambos grupos de pacientes presentan signos de hipoxia tisular, sin embargo, parece haber un mayor grado de endotelialitis y trombosis en los pulmones de los pacientes con COVID-19 frente a H1N1 (esto podría explicar por qué la anticoagulación profiláctica puede no ser suficiente en COVID-19, pero aún queda por demostrar)
- Existe una superposición entre las dos enfermedades, pero parece que COVID-19 parece ser más un proceso de enfermedad endotelial que alveolar como el principal impulsor (los estudios y debates futuros deberían analizar los tratamientos centrados en este aspecto de la enfermedad)
Referencias:
- Ackermann M et al. Endotelialitis vascular pulmonar, trombosis y angiogénesis en COVID-19. NEJM 2020. [ Publicación electrónica antes de la impresión ]
- Teuwen LA et al. COVID-19: La vasculatura desatada. Nature Reviews Immunology 2020. [ Publicación electrónica antes de imprimir ]
Publicación revisada por pares por: Anand Swaminathan, MD (Twitter: @EMSwami )
La publicación COVID-19 vs H1N1: Similares pero diferentes apareció por primera vez en REBEL EM - Blog de Medicina de Emergencia .


