
 Se ha implicado que la familia Coronaviridae y sus géneros de coronavirus tienen capacidades neurotrópicas y neuroinvasivas en huéspedes humanos (Bohmwald 2018). Se han asociado con el desarrollo de síntomas neuropsiquiátricos, actividad convulsiva, encefalomielitis, parálisis flácida aguda, trombosis del seno venoso cerebral, síndrome de Guillain-Barré, así como enfermedad cerebrovascular (Bohmwald 2018, St Jean 2004).
Se ha implicado que la familia Coronaviridae y sus géneros de coronavirus tienen capacidades neurotrópicas y neuroinvasivas en huéspedes humanos (Bohmwald 2018). Se han asociado con el desarrollo de síntomas neuropsiquiátricos, actividad convulsiva, encefalomielitis, parálisis flácida aguda, trombosis del seno venoso cerebral, síndrome de Guillain-Barré, así como enfermedad cerebrovascular (Bohmwald 2018, St Jean 2004).
Recientemente, ha habido un creciente conjunto de pruebas que respaldan la asociación del SARS-CoV2 con anomalías neurológicas. Una revisión sistemática que analizó la incidencia de enfermedades neurológicas secundarias en pacientes diagnosticados con SARS-CoV2 encontró que las tasas varían entre el 6% y el 36,4% (Herman 2020).
En el momento de este envío, ha habido diez informes de mielitis transversa aguda (ATM) atribuidos al SARS-CoV2, y otros se están enviando actualmente o están en preimpresión en este momento (consulte la infografía a continuación).
La ATM tiene una presentación variada y se asocia con una morbilidad y mortalidad significativas que requieren una mayor conciencia y vigilancia por parte del médico. Esto se ha vuelto especialmente importante a la luz de un posible vínculo causal de ATM con SARS-CoV2 con casos emergentes durante la pandemia de COVID-19.
Aquí, revisamos las características más destacadas de la ATM infecciosa (tanto parainfecciosa como posinfecciosa) para aumentar el reconocimiento de esta entidad patológica.

Definición : La mielitis transversa se define como una mielopatía inflamatoria que se asocia con una variedad de etiologías diferentes, tanto compresivas como no compresivas.
La mielitis transversa aguda infecciosa es un subtipo que se define como una inflamación aguda de la médula espinal precipitada por una agresión infecciosa (incluido el SARS-CoV2) que provoca déficits neurológicos.
 Epidemiología :
Epidemiología :
Incidencia : tasa de incidencia general de 1 a 8 casos nuevos por millón al año, pero datos recientes muestran que puede llegar a 31 casos por millón (Borchers 2012, Frohman 2010).
- El 20-30% de los casos de ATM ocurren en la población pediátrica
- Un estudio multicéntrico retrospectivo estimó que la tasa de ATM infecciosa o parainfecciosa es del 17,3% en general (de Seze 2005)
Edad : pico bimodal entre los 10 y 20 años y entre los 30 y 40 años, con una edad media de inicio entre los 35 y 40 años (Borchers 2012)
Género : la mayoría de los estudios muestran que hombres y mujeres se ven igualmente afectados y algunos estudios muestran un predominio de pacientes femeninos (Borchers 2012, Frohman 2010).
Morbilidad y mortalidad :
- Altamente variable: un tercio de los pacientes presenta un curso de la enfermedad grave y rápidamente progresivo.
- Un tercio de los pacientes experimentan un buen resultado con una recuperación completa.
- El tercio restante de los pacientes experimenta déficits funcionales y ambulatorios de leves a moderados (Borchers 2012)
Factores de mal pronóstico :
- Dolor de espalda
- Tiempo hasta el déficit máximo en 24 horas
- Afectación longitudinal de la médula espinal (Borchers 2012)
Patogénesis :
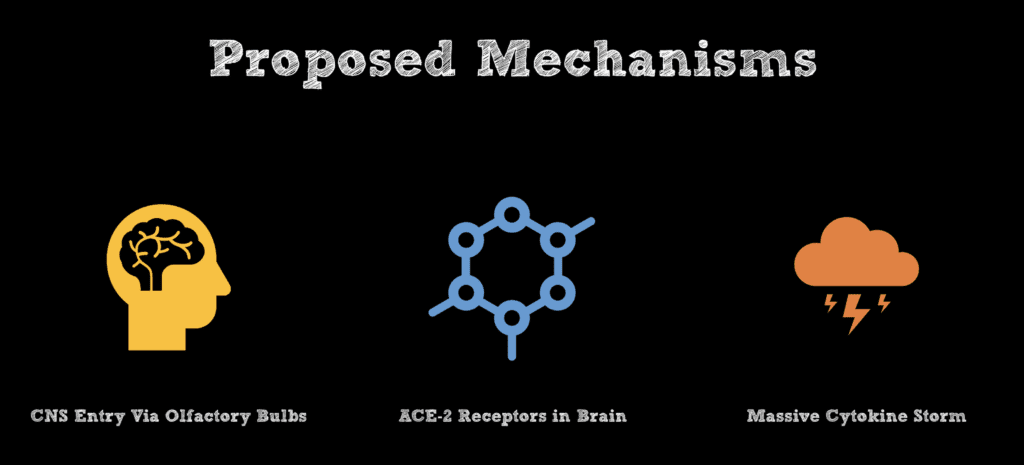
Se desconoce la patogénesis actual de la ATM secundaria al SARS-CoV2. Algunas hipótesis propuestas se enumeran a continuación.
- Hipótesis propuesta : Estudios anteriores en ratones han propuesto que el coronavirus humano puede llegar al SNC a través de los bulbos olfatorios, seguido de propagación y detección en todo el tejido cerebral días después a través de la propagación axonal retrógrada. Se plantea la hipótesis de que la infección viral posterior de las células neuronales y gliales del SNC desencadena la desmielinización y una respuesta inflamatoria (Bohmwald 2018).
- Hipótesis propuesta : Interacción del SARS-CoV2 con la enzima convertidora de angiotensina 2 (ACE2) expresada en las células gliales y las neuronas espinales (Bang 2020).
- Hipótesis propuesta : daño indirecto al sistema nervioso central a través de la liberación masiva de citoquinas que causa una alteración de la autorregulación cerebral posterior (Jenny 2019).
Historia y Física :
Factores de riesgo :
- La ATM posinfecciosa o parainfecciosa requiere exposición a una fuente infecciosa
- Los pacientes pueden presentar o no síntomas que indiquen que han provocado la infección.
- Cajero automático SARS-CoV2: la exposición, los síntomas o el diagnóstico de SARS-CoV2 aumentan el riesgo
Síntomas : la ATM puede tener síntomas neurológicos motores, sensoriales y autónomos variados y es fácil pasarla por alto.
- Los síntomas pueden evolucionar durante horas o días.
- La médula espinal torácica es la ubicación más comúnmente afectada (Frohman 2010)
- Los síntomas más comunes incluyen síntomas de vejiga autónoma (casi 100%), parestesia de miembros inferiores (80-95%), alodinia (80%), paraparesia (50%) y dolor de espalda (30-50%) (Awad 2011).
-
Debilidad motora : típicamente bilateral y por debajo de un nivel de médula espinal bien definido.
- También se han descrito síndromes unilaterales.
- Clásicamente, se observan signos de la neurona motora superior, como la hiperreflexia y la presencia del signo de Babinski.
- En la fase aguda puede producirse una paraparesia o cuadriparesia ascendente grave de inicio rápido con arreflexia e hipotonía, lo que dificulta el diagnóstico.
-
Anomalías sensoriales : nivel sensorial troncal bien definido por debajo del cual se pierde la sensación de dolor y temperatura.
- También se han observado parestesias ascendentes hasta el nivel de la lesión de la médula espinal.
-
Disfunción autonómica :
- Disfunción intestinal y vesical
- Hipotensión ortostática
- Desregulación de la temperatura
- Disfunción sexual
Diagnóstico :
El diagnóstico de ATM posinfecciosa o parainfecciosa se basa en criterios de diagnóstico uniformes publicados por el Transverse Myelitis Consortium Working Group (TMCWG 2002).
Estos criterios se basan en la exclusión de la etiología compresiva extraaxial junto con la inclusión de disfunción sensorial, motora o autonómica bilateral atribuida a un nivel sensorial de la médula espinal claramente definido con evidencia de inflamación de la médula espinal a través del líquido cefalorraquídeo (LCR) o imágenes por resonancia magnética. (MRI) (TMCWG 2002).
Criterios de inclusión :
- Desarrollo de disfunción sensorial, motora o autónoma atribuible a la médula espinal.
- Signos y/o síntomas bilaterales (aunque no necesariamente simétricos)
- Nivel sensorial claramente definido
- Exclusión de etiología compresiva extraaxial mediante neuroimagen (MRI o mielografía; TC de columna no adecuada)
- Inflamación dentro de la médula espinal demostrada por pleocitosis del LCR o índice elevado de IgG o realce con gadolinio. Si no se cumple ninguno de los criterios inflamatorios al inicio de los síntomas, repita la evaluación por resonancia magnética y punción lumbar entre 2 y 7 días después del inicio de los síntomas.
- Progresión al nadir entre las 4 h y el día 21 después del inicio de los síntomas (si el paciente se despierta con síntomas, los síntomas deben volverse más pronunciados desde el momento en que se despierta)
Criterio de exclusión :
- Historial de radiación previa a la columna en los últimos 10 años.
- Déficit clínico claro de distribución arterial compatible con trombosis de la arteria espinal anterior.
- Huecos de flujo anormales en la superficie de la médula espinal compatibles con MAV
- Evidencia serológica o clínica de enfermedad del tejido conectivo o enfermedad autoinmune (no excluye mielitis transversa asociada a la enfermedad)
- Anomalías en la resonancia magnética cerebral que sugieren esclerosis múltiple (no excluye la mielitis transversa asociada a la enfermedad)
- Historia de neuritis óptica clínicamente aparente (no excluye mielitis transversa asociada a la enfermedad)
Laboratorios : los laboratorios de rutina no son útiles en el diagnóstico del departamento de emergencias, pero están diseñados para ayudar en el manejo de pacientes hospitalizados y descartar otras etiologías.
- Suero: CBC, CMP, UA con cultivo, hemocultivos, VIH, RPR, TSH, ESR/CRP, pruebas serológicas dirigidas para causas infecciosas (Frohman 2010)
- Análisis autoinmune: anticuerpos NMO-IgG, ANA, RF, ANCA (Beh 2013)
- Punción lumbar:
- El estudio completo incluye recuento de células del LCR con diferencial, proteínas, glucosa, VDRL, índice de IgG, bandas oligoclonales, análisis citológico y cultivo (Beh 2013)
- La presencia de pleocitosis o un índice elevado de IgG es consistente con una mielitis inflamatoria (Frohman 2010)
- La mielitis viral a menudo mostrará una pleocitosis predominantemente linfocítica y un nivel elevado de proteínas en el LCR (Kincaid 2006)
Imágenes
- Radiografía de tórax: para evaluar la presencia de etiología pulmonar infecciosa
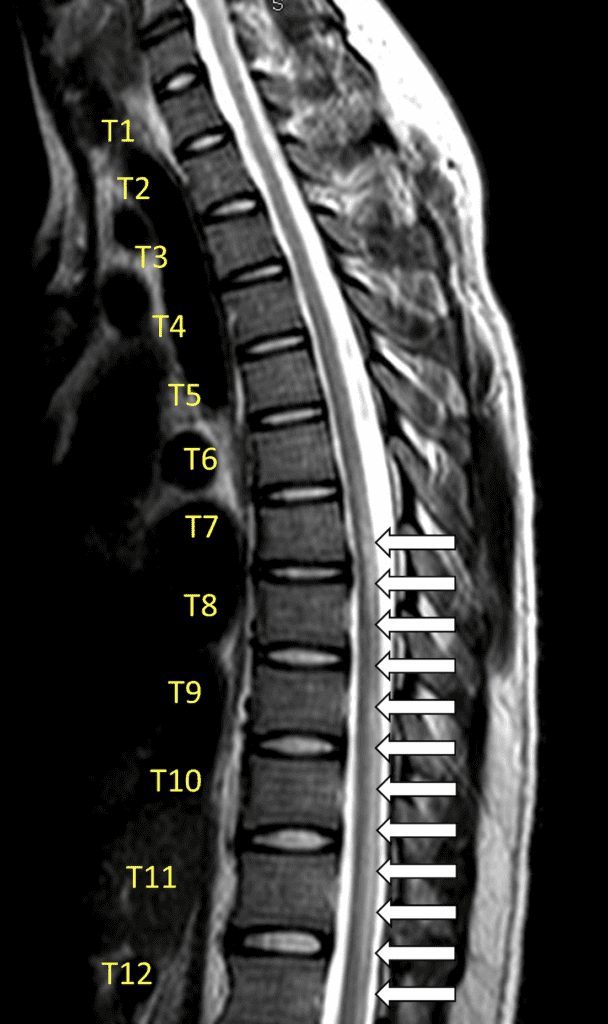
- Resonancia magnética mejorada con gadolinio de toda la columna vertebral: estándar de oro para el diagnóstico (Frohman 2010)
- Sirve para descartar etiologías compresivas o estructurales que requieran descompresión quirúrgica.
- Una vez que se excluyen las etiologías compresivas extraaxiales, la resonancia magnética puede mostrar evidencia de inflamación de la médula espinal caracterizada por una lesión intramedular de la médula espinal con realce de gadolinio.
- Clásicamente, la resonancia magnética demuestra lesiones de la médula espinal hiperintensas en T2 que se extienden a más de dos segmentos e involucran más de dos tercios del área transversal de la médula (Goh 2011)
- Resonancia magnética del cerebro con y sin gadolinio: si hay sospecha de esclerosis múltiple o sospecha de desmielinización que se extiende más allá de la médula espinal (Borchers 2012)
- Mielografía por TC: la capacidad limitada para visualizar la médula espinal hace que esta modalidad de imágenes sea útil sólo si la resonancia magnética está contraindicada (Borchers 2012).
Manejo : El objetivo del tratamiento durante la fase aguda es abordar la causa parainfecciosa subyacente, si está presente, y detener la progresión de la lesión inflamatoria de la médula espinal (Frohman 2010)
- Corticosteroides: tratamiento estándar de primera línea, aunque no se han realizado ensayos controlados aleatorios y la evidencia de apoyo proviene de estudios de casos y opiniones de expertos (Frohman 2010).
- Metilprednisolona intravenosa en dosis altas, 1000 mg al día durante 3 a 7 días
- Actualmente no hay pruebas de un corticosteroide específico o de una vía de administración (Frohman 2010, Borchers 2012)
- Se han utilizado regímenes orales en pacientes con episodios leves de mielitis (Frohman 2010)
- Intercambio de plasma: terapia de rescate en pacientes sin respuesta a los corticosteroides (Frohman 2010)
- El uso del recambio plasmático está respaldado por ensayos aleatorios en casos graves que no responden al uso de corticosteroides en pulsos (Awad 2011)
- Ciclofosfamida e IVIG
- Actualmente no hay pruebas que respalden el uso de ciclofosfamida para la mielitis y las pruebas que las respaldan se derivan de estudios retrospectivos con poco poder estadístico (Awad 2011)
- De manera similar, no existe evidencia de alta calidad que respalde el uso rutinario de IGIV.
Puntos para llevar a casa :
Publicación invitada por:

Muhammad Durrani, DO, MS
Subdirector de pasantía, Subdirector de investigación
Departamento de Emergencias del Centro Médico Inspira
Vineland, Nueva Jersey, EE.UU.
Gorjeo: @IbbyDurrani
Referencias:
- Bohmwald K et al. Alteraciones neurológicas por infecciones por virus respiratorios. Front Cell Neurosci 2018. PMID: 30416428
- St-Jean J et al. Coronavirus respiratorio humano OC43: estabilidad genética y neuroinvasión. J Virol 2004. PMID: 15280490
- Herman C et al. Revisión del alcance de la prevalencia de comorbilidades neurológicas en pacientes hospitalizados por COVID-19. Neurología 2020. PMID: 32345728
- Alkebti R et al. Mielitis aguda como complicación neurológica de Covid-19: reporte de un caso y hallazgos de resonancia magnética. Representante de caso de Radiol 2020. PMID: 32685076
- Chow C et al. Mielitis transversa aguda en la infección por COVID-19. Representante de caso de BMJ 2020. PMID: 32784242
- Durrani M et al. Mielitis transversa aguda secundaria al síndrome respiratorio agudo severo por coronavirus 2 (SARS-CoV-2): reporte de un caso. Clin Pract Cases Emerg Med 2020. Enlace aquí
- Munz M et al. Mielitis transversa aguda después de la neumonía por COVID-19. J Neurol 2020. PMID: 32458198
- Paterson R et al. El espectro emergente de la neurología COVID-19: hallazgos clínicos, radiológicos y de laboratorio. Cerebro 2020. PMID: 32637987
- Sarma D et al. Reporte de un caso de mielitis transversa aguda después de una infección por el nuevo coronavirus. Clin Pract Cases Emerg Med 2020. Enlace aquí
- Valiuddin H et al. Mielitis transversa aguda asociada al SARS-CoV-2: reporte de un caso. Brain Behav Immun Health 2020. Enlace aquí
- Zachariadis A et al. Mielitis transversa relacionada con la infección por COVID-19. J Neurol 2010. PMID: 32601756
- Zhao K et al. Mielitis aguda tras la infección por SARS-CoV-2: reporte de un caso. medRxiv 2020. Enlace aquí
- Borchers A et al. Mielitis transversa. Autoinmune Rev 2012. PMID: 21621005
- Frohman E et al. Práctica clinica. Mielitis transversa. N Engl J Med 2010. PMID: 20818891
- de Seze J et al. Mielitis transversa aguda idiopática: aplicación de los criterios diagnósticos recientes. Neurología 2005. PMID: 16380618
- Bang A et al. Evidencia del virus COVID-19 dirigido al SNC: distribución tisular, interacción huésped-virus y mecanismos neurotrópicos propuestos. ACS Chem Neurosci 2020. PMID: 32167747
- Jenny N y otros. Citoquinas inflamatorias y riesgo de accidente cerebrovascular isquémico: la cohorte REGARDS. Neurología 2019. PMID: 31004072
- Awad A et al. Mielitis transversa idiopática y neuromielitis óptica: perfiles clínicos, fisiopatología y opciones terapéuticas. Curr Neuropharmacol 2011. PMID: 22379456
- Grupo de trabajo del Consorcio de Mielitis Transversa (TMCWG). Criterios diagnósticos y nosología propuestos para la mielitis transversa aguda. Neurología 2002. PMID: 12236201
- Beh S et al. Mielitis transversa. Neurol Clin 2013. PMID: 23186897
- Kincaid O et al. Mielitis viral: una actualización. Curr Neurol Neurosci Rep 2006. PMID: 17074281
- Goh C et al. Neuroimagen en mielitis transversa aguda. Neuroimagen Clin N Am 2011. PMID: 22032509
Publicación revisada por pares por: Anand Swaminathan, MD (Twitter: @EMSwami ) y Salim R. Rezaie, MD (Twitter: @srrezaie )
La publicación Mielitis transversa aguda infecciosa secundaria a COVID-19 apareció por primera vez en REBEL EM - Blog de Medicina de Emergencia .

