
 Antecedentes: la gestión actual de la COVID-19 se centra en la atención de apoyo, ya que aún no existen tratamientos sólidos basados en datos. Hasta la fecha, apenas ha habido un rayo de esperanza basado en la evidencia publicada, ya que la mayoría de los estudios son de mala calidad o demuestran resultados “negativos”. Ahora se han publicado dos ensayos más que analizan algunas opciones nuevas como candidatos potenciales.
Antecedentes: la gestión actual de la COVID-19 se centra en la atención de apoyo, ya que aún no existen tratamientos sólidos basados en datos. Hasta la fecha, apenas ha habido un rayo de esperanza basado en la evidencia publicada, ya que la mayoría de los estudios son de mala calidad o demuestran resultados “negativos”. Ahora se han publicado dos ensayos más que analizan algunas opciones nuevas como candidatos potenciales.
Artículo: Fan-Hgai Hung I et al. Combinación triple de interferón beta-1b, lopinavir-ritonavir y ribavarina en el tratamiento de pacientes ingresados en el hospital con COVID-19: un ensayo de fase 2, aleatorizado, abierto. Lancet 2020. [ Publicación electrónica antes de la impresión ]
Pregunta clínica: ¿La combinación de interferón beta-1b, lopinavir-ritonavir y ribavirina o lopinavir-ritonavir solos ayuda a acelerar una disminución en el tiempo hasta que el hisopo nasofaríngeo sea negativo para SARS-CoV-2?
Que hicieron:
- Ensayo multicéntrico, prospectivo, abierto y aleatorizado de fase 2 en adultos con COVID-19 ingresados en 6 hospitales de Hong Kong
- Pacientes asignados aleatoriamente (2:1) a:
-
Grupo de combinación: combinación 14 días de lopinavir/ritonavir 400 mg/100 mg BID + ribavirina 400 mg BID + 3 dosis de 8 millones de UI de interferón beta-1b en días alternos
- Para los pacientes reclutados y tratados entre los días 7 y 14, se omitió el interferón beta-1b.
- Grupo control: 14 días de lopinavir/ritonavir 400 mg/100 mg dos veces al día
-
Grupo de combinación: combinación 14 días de lopinavir/ritonavir 400 mg/100 mg BID + ribavirina 400 mg BID + 3 dosis de 8 millones de UI de interferón beta-1b en días alternos
Resultados:
- Primario: momento de proporcionar un hisopo nasofaríngeo negativo para SARS-CoV-2
-
Secundario:
- Tiempo hasta la resolución de los síntomas (NOTICIAS2 de 0 mantenidas durante 24 horas)
- Puntuación diaria de NEWS2 y SOFA
- Hospital LOS
- Mortalidad 30d
- Tiempo para lograr SARS-CoV-2 negativo en todas las muestras clínicas (nasofaríngeas, orofaríngeas, garganta, heces y orina)
- Cambios diarios en la carga viral en los primeros 7 días
- Frecuencias y duración de los eventos adversos.
Inclusión:
- Edad ≥18 años
- Dio positivo a COVID-19
- Puntuación NEWS2 de al menos 1
- Duración de los síntomas de 14 días o menos al momento del reclutamiento.
- Ingresados en el hospital
Exclusión:
- Alergia o reacción grave a los medicamentos del estudio.
- Síndrome de QTc prolongado conocido, arritmias cardíacas ventriculares, bloqueo cardíaco de segundo o tercer grado, intervalo QTc ≥480 ms
- Tomar medicamentos que interactuarían con lopinavir/ritonavir, ribavirina o interferón beta-1b
- Historia conocida de depresión severa.
- Mujeres embarazadas o lactantes
- Recibió un agente experimental 1 mes antes del reclutamiento de este estudio.
- Historial de abuso de alcohol o drogas en los últimos 5 años.
Resultados:
- 127 pacientes reclutados
- Mediana de días desde el inicio de los síntomas hasta el inicio del tratamiento del estudio = 5 días
-
Tiempo medio desde el inicio del tratamiento del estudio hasta el hisopo nasofaríngeo negativo:
- Grupo combinado: 7d (rango 5 a 11)
- Grupo de control: 12d (rango 8 a 15)
- FC 4,37; IC del 95%: 1,86 a 10,24; p = 0,0010
- Alivio completo de los síntomas (NOTICIAS2 de 0):
- Grupo combinado: 4d (rango 3 a 8)
- Grupo de control: 8d (rango 7 a 9)
- FC 3,92; IC del 95%: 1,66 a 9,23; p<0,0001
- Alivio completo de los síntomas (puntuación SOFA de 0):
- Grupo combinado: 3d (rango 1 a 8)
- Grupo de control: 8d (rango 6,5 a 9,0)
- FC 1,89; IC del 95%: 1,03 a 3,49; p = 0,041
- LOS hospitalarios medios:
- Grupo combinado: 9d (rango 7 a 13)
- Grupo de control: 14,5d (rango 9,3 a 16,0)
- FC 2,72; IC del 95%: 1,2 a 6,13; p = 0,016
- El tratamiento combinado se asoció con un tiempo significativamente más corto hasta la carga viral negativa en todas las muestras (nasofaríngeas, posturales orofaríngeas, garganta y heces).
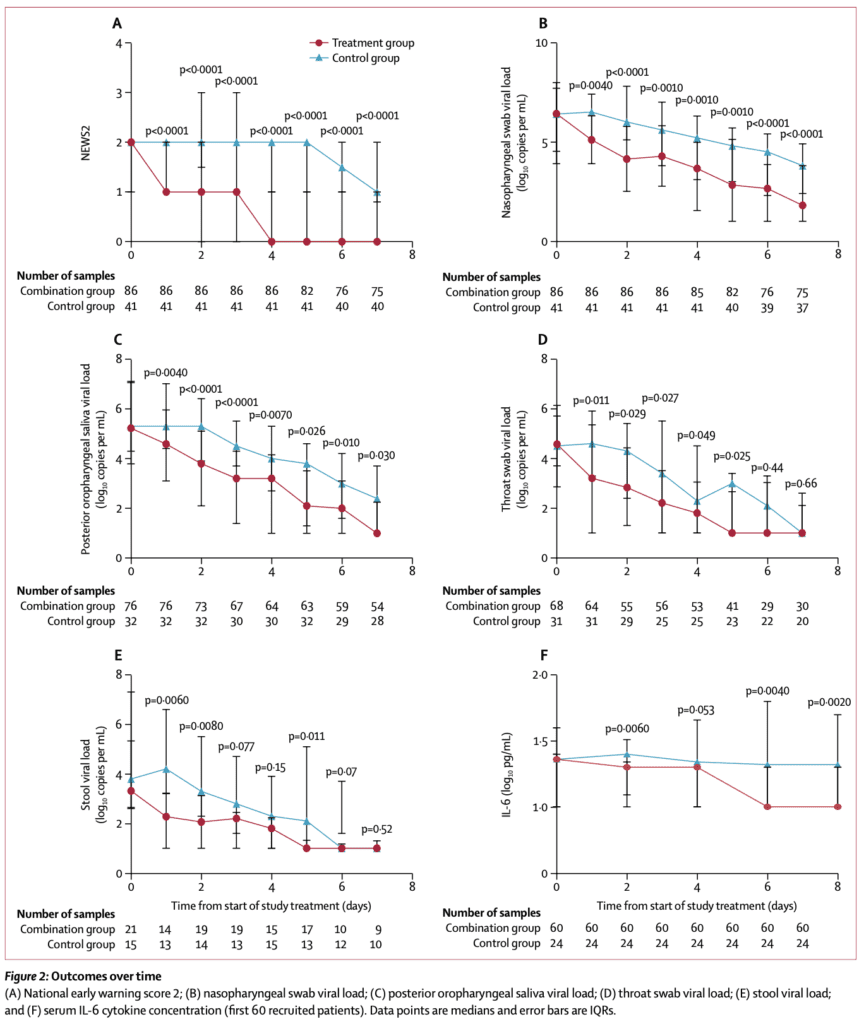
- Los niveles de IL-6 fueron significativamente más bajos en el grupo combinado en comparación con el grupo de control los días 2, 6 y 8
- Eventos adversos:
- Grupo combinado: 48%
- Grupo de control: 49%
- El evento adverso más común fue: diarrea (41%)
- La mayoría de los eventos adversos se resolvieron dentro de los 3 días posteriores al inicio del fármaco.
- NO hubo eventos adversos graves en el grupo combinado
- 1 paciente en el grupo de control desarrolló hepatitis bioquímica por lopinavir-ritonavir
- Ningún paciente murió durante el estudio.
Fortalezas:
- 1er ECA sobre la combinación triple de interferón beta-1b, lopinavir-ritonavir y ribavirina, en comparación con el monoterapia lopinavir-ritonavir en el tratamiento de pacientes ingresados en el hospital con COVID-19
- El resultado primario es objetivo, aunque es la eliminación viral. Se prefieren los resultados objetivos, especialmente en un estudio abierto.
- Pacientes bien equilibrados entre grupos.
- La mayoría de los pacientes fueron ingresados en el hospital dentro de los 7 días posteriores a la aparición de los síntomas, lo que permitió el reclutamiento en un ensayo clínico durante la primera parte de COVID-19.
- Pacientes consecutivos inscritos
Limitaciones:
- Cálculo del tamaño de la muestra basado en el tratamiento con lopinavir-ritonavir del ensayo SARS-CoV de 2003, con una diferencia estimada del 26,4 % en la tasa de mortalidad o SDRA a los 21 días.
- El resultado primario fue un resultado orientado a la enfermedad (tiempo hasta el hisopo nasofaríngeo negativo), no un resultado orientado al paciente
- Aunque el resultado primario es de naturaleza objetiva, es importante tener en cuenta que la prueba RT-PCR tiene solo un 75 % de sensibilidad, por lo que algunos pacientes pueden haber tenido resultados falsos negativos al afirmar que el tratamiento fue exitoso cuando en realidad ese no es el caso. Además, es importante el método de obtención de hisopos nasales.
- Inscripción consecutiva poco clara de pacientes
- Estudio abierto que puede sesgar los resultados, especialmente porque muchos de los resultados son subjetivos.
- No hay grupo de placebo para comparar
- No está claro si los evaluadores de resultados estaban cegados a la asignación del tratamiento
- Resultados de confusión en un subgrupo de pacientes que omitieron el interferón beta-1b dentro del grupo combinado
- La ausencia de pacientes críticos dificulta la extrapolación de los resultados a una población de UCI
Discusión:
- Aunque el resultado primario fue el tiempo hasta el hisopo nasofaríngeo negativo, esto también pareció correlacionarse con la mejoría clínica, como se muestra en la reducción de NEWS2 y la duración de la estancia hospitalaria. Además, el perfil de efectos secundarios pareció en general leve y autolimitado.
- NOTA IMPORTANTE: Esta es una cohorte relativamente buena de pacientes que fueron tratados temprano en el curso de la infección con síntomas mínimos. Si más estudios respaldan los resultados de este ensayo, el beneficio de esta combinación de medicamentos sería en pacientes ambulatorios con síntomas leves, lo que significa una captura temprana de los pacientes. Estos resultados no deben aplicarse a aquellos pacientes ingresados en el hospital con enfermedad de moderada a grave (ya en tormenta de citoquinas)
- Estudios adicionales deberían dilucidar qué medicación era necesaria. Se necesitarán grandes ECA doble ciego
- A los pacientes les fue bien independientemente del grupo de tratamiento en el que estuvieran. Esta duración más corta es útil por dos razones principales:
- Reducir la transmisión (pero necesitaría un uso amplio)
- Hacer que los pacientes vuelvan a trabajar, pero sin pruebas, ¿volverán a trabajar sin inmunidad y potencialmente reexpuestos?
- En Hong Kong, la práctica estándar es permanecer en el hospital hasta que los hisopos virales nasofaríngeos sean negativos en 2 días consecutivos.
- En el grupo combinado, la terapia triple no se utilizó en pacientes que se presentaron 7 días o más después del inicio de los síntomas debido a preocupaciones sobre los efectos secundarios proinflamatorios. El interferón beta-1b es una citocina que se utiliza para ayudar a reactivar el sistema inmunológico hasta que la terapia antiviral comience a ser efectiva. Por lo tanto, podría ser potencialmente perjudicial después de 7 días de enfermedad.
Conclusión del autor: “La terapia antiviral triple temprana fue segura y superior a lopinavir-ritonavir solo para aliviar los síntomas y acortar la duración de la eliminación viral y la estancia hospitalaria en pacientes con COVID-19 leve a moderado. Se justifica un estudio clínico futuro de una terapia antiviral doble con interferón beta-1b como base”.
Punto clínico para recordar: La terapia antiviral triple con interferón beta-1b, lopinavir-ritonavir y ribavirina utilizada en las primeras etapas de la enfermedad (<7 días) pareció respaldar la mejora en el resultado principal, que fue la reducción de la eliminación viral y el alivio de los síntomas. Estos hallazgos también se correlacionaron con un alta más rápida de los pacientes con COVID-19 de leve a moderado.
Artículo: Cavalli G et al. Bloqueo de interleucina-1 con dosis altas de Anakinra en pacientes con COVID-19, síndrome de dificultad respiratoria aguda e hiperinflamación: un estudio de cohorte retrospectivo. Lancet 2020. [ Publicación electrónica antes de la impresión ]
Pregunta clínica: En pacientes con COVID-19 que reciben ventilación no invasiva con SDRA e hiperinflamación, ¿la adición de anakinra al tratamiento estándar mejora los resultados clínicos a los 21 días en comparación con una cohorte histórica de pacientes que no reciben anakinra?
Que hicieron:
- Estudio de cohorte retrospectivo en Italia de pacientes consecutivos con COVID-19
- Todos los pacientes también recibieron el tratamiento estándar con:
- Hidroxicloroquina 200 mg dos veces al día
- Lopinavir/ritonavir 400 mg/100 mg dos veces al día
- Tratamiento adicional:
- Anakinra 5 mg/kg IV dos veces al día (dosis alta)
- Anakinra 100 mg dos veces al día (dosis baja)
- Solo tratamiento estándar + VNI: del 10 al 17 de marzo (16 pacientes)
- Anakinra en dosis altas + VNI + tratamiento estándar: del 17 al 27 de marzo (29 pacientes)
- Anakinra en dosis bajas + VNI + tratamiento estándar: del 10 al 17 de marzo (7 pacientes: interrumpido después de 7 días debido a la falta de efecto sobre la PCR sérica y el estado clínico)
Resultados:
- Beneficio clínico sostenido (reducción del 75 % en la PCR sérica) y beneficio respiratorio sostenido (relación P/F >200 mg) durante al menos 2 días, o hasta que surja la muerte, bacteriemia o efectos secundarios (es decir, aumento en las LFT > 3x UNL)
- Supervivencia
- Supervivencia libre de ventilación mecánica
- Cambio en la relación P/F
- Cambio en la PCR sérica
- Estado clínico utilizando una escala ordinal de 7 puntos recomendada por la OMS
Inclusión:
- Edad ≥18 años
- SDRA de moderado a grave
- Hiperinflamación (PCR sérica ≥1 mg/L, ferritina ≥900 ng/mL, o ambas)
- VNI fuera de la UCI
Exclusión:
- Ya ingresado en UCI para ventilación mecánica
- Evidencia de infección bacteriana.
- Administración concomitante de otros agentes antiinflamatorios o glucocorticoides.
- Inscrito concomitantemente en otro ensayo clínico.
Resultados:
-
Antes del inicio de anakinra:
- PCR media: 164 mg/l
- Ferritina media 1237ng/mL
- Todos los pacientes con CPAP con una mediana de relación P/F de 77
- 25 (86%) de los pacientes con SDRA grave (P/F ≤100 mmHg)
-
7 pacientes recibieron anakinra SQ en dosis bajas (100 mg dos veces al día)
- A los 7 días: no hay reducciones en la PCR ni en el estado clínico.
- Sin preocupaciones de seguridad
- La falta de efectos clínicos o antiinflamatorios significativos llevó a la interrupción temprana
-
29 pacientes recibieron dosis altas de anakinra intravenoso (5 mg/kg dos veces al día)
- Duración media del tratamiento 9d
- Mejora de la función respiratoria después de 21 días
- Anakinra en dosis altas: 21/29 pacientes (72%)
- Tratamiento estándar: 8/16 (50%)
- Ventilación Mecánica después del 21d:
- Anakinra en dosis altas: 5/29 pacientes (17%)
- Tratamiento estándar: 1/16 pacientes (6%)
- Muerto a los 21d
- Anakinra en dosis altas: 3/29 (10%)
- Tratamiento estándar: 7/16 (44%)
- A los 21 días, la supervivencia fue del 90 % en el grupo de dosis alta de anakinra y del 56 % en el grupo de tratamiento estándar (p = 0,009)
- La supervivencia sin ventilación mecánica fue del 72 % en el grupo de anakinra frente al 50 % en el grupo de tratamiento estándar (p = 0,15)
- El tratamiento con dosis altas de anakinra se asoció con reducciones rápidas de la PCR sérica y una mejora en los índices P/F durante 14 días en comparación con la atención estándar.
-
Anakinra en dosis altas tolerada en la mayoría de los pacientes.
- Se suspendió por eventos adversos en 7 (24%) de los pacientes después de una mediana de duración del tratamiento de 9 días.
- 4 (14%) pacientes tuvieron bacteriemia
- 3 (10%) tuvieron elevación en las LFT
- La interrupción del tratamiento con anakinra no fue seguida de recaídas inflamatorias.
- NOTA IMPORTANTE: la bacteriemia y el aumento de las LFT también se produjeron en 2 (13 %) de los pacientes y en 5 (31 %) de los pacientes que recibieron tratamiento estándar, respectivamente.
- Se suspendió por eventos adversos en 7 (24%) de los pacientes después de una mediana de duración del tratamiento de 9 días.
Fortalezas:
- Evaluación de un medicamento dirigido a pacientes con COIVD-19, hiperinflamación y SDRA fuera de la UCI, para prevenir la muerte o una intensificación de la atención
- Utilizó una justificación sólida para el uso de medicamentos basada en la fisiopatología.
- Los grupos parecen estar bien equilibrados al inicio
- Se revisó la evidencia previa para evaluar la efectividad de dosis altas de anakinra intravenoso.
- Supervivencia evaluada y supervivencia sin ventilación mecánica (ambos resultados orientados al paciente)
Limitaciones:
- El ensayo retrospectivo antes y después con un tamaño de muestra pequeño limita la interpretación de los resultados y dificulta sacar conclusiones definitivas.
- No existe un resultado primario a priori. Este estudio fue parte de un estudio más amplio que tampoco tiene resultados establecidos (es decir, solo descriptivos).
- El resultado resaltado no está centrado en el paciente
- No está claro cómo se seleccionaron los pacientes para participar (es decir, no está claro el reclutamiento consecutivo o por conveniencia)
- NO hay cegamiento ya que este no es un ensayo clínico aleatorizado que introduce sesgo ya que los evaluadores de resultados no estaban cegados.
- En la conclusión, los autores afirman la "seguridad" de la medicación, sin embargo, no se puede demostrar la seguridad con un estudio tan pequeño.
- El estudio de antes y después puede haber visto mejoras en la atención de un período a otro a medida que entendíamos más sobre la enfermedad, lo que hace que el estudio parezca favorable al último grupo.
Discusión:
- Anakinra es un antagonista del receptor de interleucina (IL)-1 que bloquea la actividad de las citocinas proinflamatorias IL-1alfa e IL-1beta. Fisiopatológicamente, hay un subconjunto de pacientes con COVID-19 que se asemejan a la tormenta de citoquinas observada después del tratamiento con células T del receptor de antígeno quimérico (CAR-T) o pacientes con síndrome de activación de macrófagos.
- Una de las ventajas de anakinra es que, en comparación con otros agentes bloqueadores de citoquinas, es relativamente seguro, tiene una vida media corta (3 horas), lo que permite una interrupción inmediata, lo cual es excelente en pacientes críticamente enfermos.
- Este ensayo destaca la importancia no solo de reducir la mortalidad sino también de prevenir el ingreso a la UCI en un grupo de pacientes con COVID-19, bajo VNI en salas médicas. En áreas donde los sistemas de salud están abrumados, la cantidad de pacientes con SDRA puede exceder la capacidad máxima de las UCI, por lo tanto, tratar al paciente en un momento más temprano de la enfermedad no solo podría disminuir la mortalidad, sino también disminuir la necesidad de un nivel de atención en la UCI.
Conclusión del autor: “En este estudio de cohorte retrospectivo de pacientes con COVID-19 y SDRA tratados con ventilación no invasiva fuera de la UCI, el tratamiento con dosis altas de anakinra fue seguro y se asoció con una mejoría clínica en el 72% de los pacientes. La confirmación de la eficacia requerirá ensayos controlados”.
Punto clínico para recordar: Esta pequeña retrospectiva antes y después del ensayo con dosis altas de anakinra (5 mg/kg IV dos veces al día), nos brinda una prueba de concepto en el tratamiento de COVID-19, que debería sentar las bases para la replicación en ensayos más grandes.
Referencias:
- Fan-Hgai Hung I et al. Combinación triple de interferón beta-1b, lopinavir-ritonavir y ribavarina en el tratamiento de pacientes ingresados en el hospital con COVID-19: un ensayo de fase 2, aleatorizado, abierto. Lancet 2020. [ Publicación electrónica antes de la impresión ]
- Cavalli G et al. Bloqueo de interleucina-1 con dosis altas de Anakinra en pacientes con COVID-19, síndrome de dificultad respiratoria aguda e hiperinflamación: un estudio de cohorte retrospectivo. Lancet 2020. [ Publicación electrónica antes de la impresión ]
Para obtener más ideas sobre este tema, consulte:
- PulmCrit: Anakinra en dosis altas para COVID-19: comienzan los ensayos con antiinflamatorios
- PulmCrit: Virus Wars – Regreso de Lopinavir/Ritonavir (junto con Ribavirina e Interferón)
- Conclusión:terapia triple para la COVID-19: un ECA
Publicación revisada por pares por: Anand Swaminathan, MD (Twitter: @EMSwami )
La publicación COVID-19: triple terapia antiviral e inhibición de IL-1 apareció por primera vez en REBEL EM - Blog de medicina de emergencia .


