
 Antecedentes: En REBEL Cast Episodio 73 , Anand Swaminathan y yo discutimos dos estudios recientes sobre la seguridad de los vasopresores periféricos de dos grandes ensayos [1][2]. Un correo electrónico de mi buen amigo Rory Spiegel me llamó la atención sobre otro ensayo sobre este tema [3]. Creo que todos podemos estar de acuerdo en que en pacientes con shock séptico, o shock en general, la administración temprana de agentes vasopresores puede ayudar a estabilizar a los pacientes y revertir la hipoperfusión de órganos terminales. Tradicionalmente, esto se ha realizado a través de catéteres venosos centrales (CVC) debido al hipotético riesgo de lesión por extravasación en las extremidades. La otra cara de la moneda es que los catéteres venosos centrales no están exentos de riesgos y el tiempo para colocarlos puede retrasar una terapia que pueda beneficiar a los pacientes.
Antecedentes: En REBEL Cast Episodio 73 , Anand Swaminathan y yo discutimos dos estudios recientes sobre la seguridad de los vasopresores periféricos de dos grandes ensayos [1][2]. Un correo electrónico de mi buen amigo Rory Spiegel me llamó la atención sobre otro ensayo sobre este tema [3]. Creo que todos podemos estar de acuerdo en que en pacientes con shock séptico, o shock en general, la administración temprana de agentes vasopresores puede ayudar a estabilizar a los pacientes y revertir la hipoperfusión de órganos terminales. Tradicionalmente, esto se ha realizado a través de catéteres venosos centrales (CVC) debido al hipotético riesgo de lesión por extravasación en las extremidades. La otra cara de la moneda es que los catéteres venosos centrales no están exentos de riesgos y el tiempo para colocarlos puede retrasar una terapia que pueda beneficiar a los pacientes.
Evidencia previa
Una revisión sistemática realizada por Loubani et al en 2015 [4] analizó 85 artículos con 270 pacientes (todos informes de casos y series de casos), en su mayoría publicados antes de 1969, y resumió los factores de riesgo de extravasación, entre ellos: mayor duración de la infusión periférica (96,8% de los efectos adversos). los eventos ocurrieron con infusiones durante ≥4 horas) y ubicaciones más distales (85,3% de los eventos de extravasación ocurrieron en el acceso intravenoso periférico distal a las fosas antecubital y poplítea).
Si analizamos la literatura, la tasa de extravasación a través del acceso intravenoso periférico oscila entre el 3 y el 6% [1][5]. Hubo un estudio de Pancaro et al [2] que era una base de datos perioperatoria de los Países Bajos. Este estudio citó una tasa de extravasación del 0,035%; sin embargo, se trataba de pacientes que no estaban en estado crítico y que recibían pequeñas dosis de vasopresores (rango de dosis de 0,02 a 0,05 ug/kg/min), tiempos de infusión cortos (≈20 min) y pequeños volúmenes de extravasación (1,5 a 4 ml). Más importante aún, ninguno de estos estudios informó episodios de necrosis tisular o isquemia de las extremidades (un resultado importante orientado al paciente).
Que hicieron:
- Revisión retrospectiva de historias clínicas en un solo centro realizada en un hospital docente académico de atención terciaria de Nueva York
- Durante este período, la institución no contaba con un protocolo para las mejores prácticas de administración de agentes vasopresores a través de un PIV.
- La dosis de vasopresor en el momento de la extravasación se convirtió en equivalentes de noradrenalina.
- Equivalentes de norepinefrina = (norepinefrina [ug/min]) + dopamina [ug/kg/min]/2) + (epinefrina [ug/min]) + (fenilefrina [ug/min/10]) + (vasopresina [unidades/h ] x 8,33)
Criterios importantes:

Resultados:
-
Primario: incidencia de eventos de extravasación relacionados con la administración periférica de un vasopresor.
- Extravasación = “La administración extravenosa de un medicamento o solución que tiene el potencial de causar daño tisular o celular grave en el tejido circundante”.
-
Secundario:
- Descripción de dosis, concentración y duración del uso de vasopresores periféricos.
- Ubicación y calibre de PIV utilizado para la administración de vasopresores
- Frecuencia y tiempo hasta la inserción del CVC
Inclusión:
- ≥18 años de edad
- Recibir un agente vasopresor a través de una PIV
- Ingresado en la UCI
Exclusión:
- Ya tenía CVC instalado
- Recibió vasopresores mediante PIV durante <1 hora
Resultados:
- 485 pacientes recibieron un vasopresor
- Se excluyeron 283 pacientes porque tenían CVC en el momento del inicio de los vasopresores.
- 202 pacientes fueron evaluados para determinar la incidencia de eventos de extravasación relacionados con vasopresores a través de un PIV
- 340 catéteres periféricos disponibles para evaluación (la mayoría de los pacientes tenían múltiples PIV)
- Duración media total de la administración de vasopresores periféricos = 11,5 horas
- Pacientes que no hicieron la transición a CVC, duración media de la administración de vasopresores periféricos = 19 horas
- Indicaciones más comunes de vasopresores: shock séptico (73%) y shock cardiogénico (14%)
- Ubicación más común de los pacientes: UCI médica (45%) y unidad médica de reducción (42%)

*Estos números me resultaron confusos inicialmente, pero la mayoría de los pacientes tenían múltiples PIV y múltiples vasopresores (es decir, el 12 % de los pacientes recibieron 2 o más vasopresores).
- Transición a CVC: 46%
- Tiempo medio hasta la inserción del CVC: 6 horas (rango 3 – 23 horas)
-
Eventos de extravasación (resultado primario):
- 8/202 pacientes (4%)
- Tiempo medio hasta la extravasación = 21 h
- Dosis media de vasopresor en equivalentes de norepinefrina en el momento de la extravasación = 0,11 ug/kg/min (8 ug/min)
- Todas las líneas, excepto 1 (yugular externa), se insertaron en la fosa antecubital o en posición distal a ella.
-
Sin isquemia ni necrosis en ninguno de los eventos de extravasación.
- 6/8 eventos (75%) resultaron en lesión de grado 1 (palidez de la piel y edema <1 pulgada)
- 2/8 eventos (25%) resultaron en lesiones de grado 2 (palidecimiento de la piel y edema de 1 a 6 pulgadas)
- 7/8 (88%) eventos resultaron en el reinicio del vasopresor periféricamente
Fortalezas:
- Datos recopilados de la infusión de vasopresores, incluida la concentración, la duración, la dosis y el tiempo hasta el CVC, cuando corresponda.
- Datos recopilados sobre eventos de extravasación, incluido el tiempo hasta la extravasación, la ubicación y el calibre del PIV, cualquier medida correctiva y el grado de gravedad del evento.
- Definió objetivamente la extravasación y utilizó una escala de infiltración para calificar los eventos de extravasación.
- ≈50% de los pacientes tenían 2 o más condiciones comórbidas que aumentaron el riesgo de extravasación, concentraciones/dosis de vasopresores variables utilizadas, PIV colocados en lugares de alto riesgo, monitoreo de los PIV cada 4 horas y ningún protocolo para el manejo de eventos de extravasación. Aunque esta no es una buena práctica, lo más probable es que sea la realidad en la que muchos utilizan vasopresores a través de PIV.
Limitaciones:
- Estudio pequeño y unicéntrico. Sin conocimiento de la incidencia inicial de eventos de extravasación graves de PIV, el tamaño de la muestra puede no ser lo suficientemente grande para capturar eventos de extravasación graves.
- Revisión retrospectiva de gráficos que hace que la información sea tan buena como la documentada en el EMR (sesgo de presentación de informes y documentación). En otras palabras, es posible que haya habido eventos que no fueron capturados o documentados en el EMR.
- Los 8 eventos de extravasación documentados en este estudio tuvieron tamaño/ubicación de PIV, vasopresor utilizado y dosis muy variables. Debido a esto y al bajo número de eventos, es difícil hacer recomendaciones basadas únicamente en este estudio.
- Aunque no hubo pacientes con isquemia o necrosis que requirieran manejo quirúrgico, solo 3 de 8 pacientes informaron detalles de la lesión tisular local.
- A pesar de una baja tasa de complicaciones (≈4%) en este estudio, sin un grupo de control, no se pueden hacer afirmaciones definitivas sobre la administración de vasopresores a través de PIV versus CVC.
Discusión:
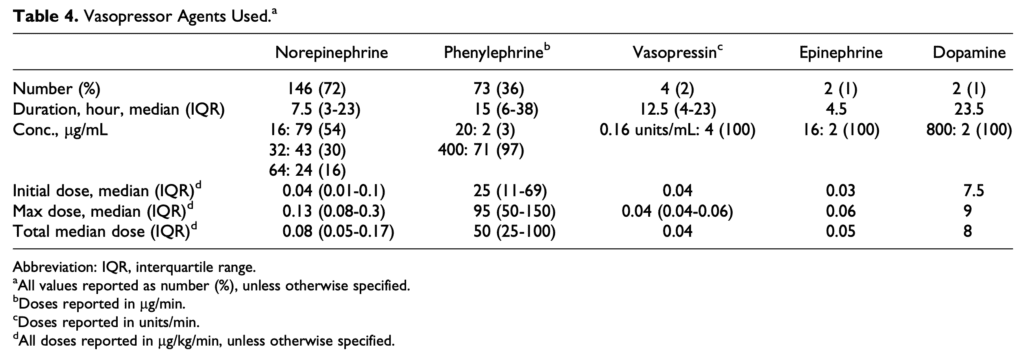
- Vasopresor administrado con mayor frecuencia = noradrenalina (72%) con una duración media de 7,5 horas
- Concentración más común de norepinefrina utilizada = 16ug/mL
- Dosis media de norepinefrina = 0,08 ug/kg/min (rango: 0,04 ug/kg/min a 0,13 ug/kg/min)
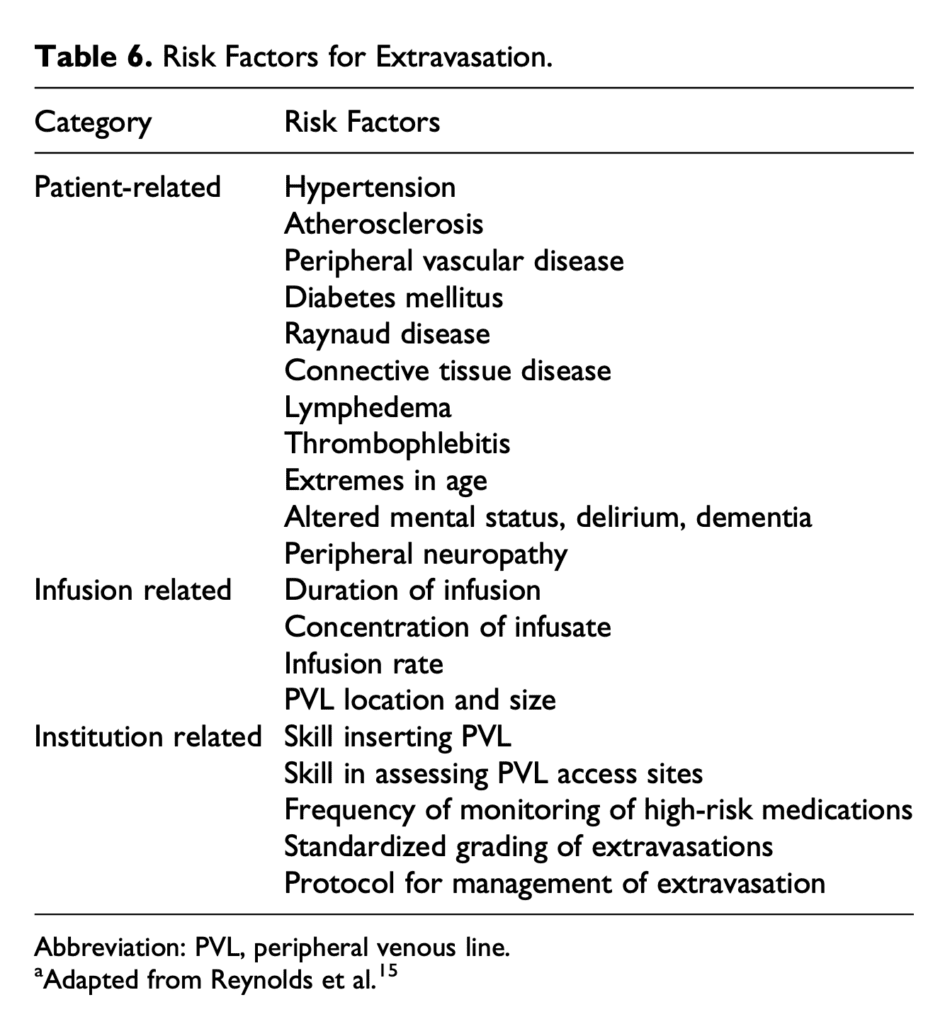
- Factores de riesgo de extravasación:
- Específico del paciente = Factores que alteran el flujo sanguíneo o debilitan los vasos sanguíneos e incapacidad para sentir o informar el dolor.
- Específico de vasopresor = Concentración del fármaco, velocidad de infusión y duración de la infusión
- Específico de la institución = Habilidad para obtener acceso, frecuencia de seguimiento y protocolo de gestión
- Lo que más me gusta de esta publicación es que publican sus protocolos (permiso otorgado por el autor principal para la publicación) para el uso de vasopresores a través de PIV: Protocolo de vasopresor periférico
- A continuación se muestra un ejemplo del Protocolo de vasopresor periférico:

Conclusión del autor: “Encontramos una incidencia general de eventos de extravasación del 4 % en pacientes que recibieron vasopresores a través de una PVL que no fueron tratados bajo un estricto protocolo de seguridad. Ninguno de estos eventos fue lo suficientemente grave como para requerir el uso de un antídoto o una intervención quirúrgica, y en 7 de los 8 casos los vasopresores se reanudaron en un sitio periférico separado”.
Punto clínico para recordar: este estudio, aunque retrospectivo y de un solo centro (serias limitaciones metodológicas), contribuye al conocimiento del uso de vasopresores a través de vías intravenosas periféricas. El riesgo documentado de lesión por extravasación del 4% en este estudio es similar a las tasas de extravasación observadas en publicaciones anteriores (es decir, 3 – 6%) y no hubo casos de isquemia o necrosis de extremidades que requirieran intervención quirúrgica. Hipotéticamente, la tasa de extravasación se puede reducir aún más mediante la implementación de protocolos de observación estrictos y protocolos de manejo de extravasación.
Referencias:
- Tian DH et al. Seguridad de la administración periférica de medicamentos vasopresores: una revisión sistemática. EMA 2019. PMID: 31698544
- Pancaro C et al. Riesgo de complicaciones importantes después de la infusión perioperatoria de norepinefrina a través de vías intravenosas periféricas en un estudio multicéntrico. Anesth Analg 2019. PMID: 31569163
- Lewis T y col. Seguridad de la administración periférica de agentes vasopresores. J Medicina de Cuidados Intensivos 2019. PMID: 28073314
- Loubani OM et al. Una revisión sistemática de la extravasación y la lesión tisular local por la administración de vasopresores a través de catéteres intravenosos periféricos y catéteres venosos centrales. J Cuidado crítico 2015. PMID: 25669592
- Medlej K et al. Complicaciones de la administración de vasopresores a través de catéteres venosos periféricos: un estudio observacional. JEM 2018. PMID: 29110979
Para obtener más ideas sobre este tema, consulte:
- REBEL EM: Mythbuster – Administración de vasopresores mediante acceso intravenoso periférico
- REBEL EM: Vasopresores periféricos: ¿seguros o peligrosos?
- REBEL EM: REBEL Cast Ep73 – ¿Son seguros los vasopresores periféricos?
Publicación revisada por pares por: Anand Swaminathan, MD (Twitter: @EMSwami )
La publicación Una actualización más sobre el uso de vasopresores intravenosos periféricos (PIV) apareció por primera vez en REBEL EM - Blog de medicina de emergencia .

